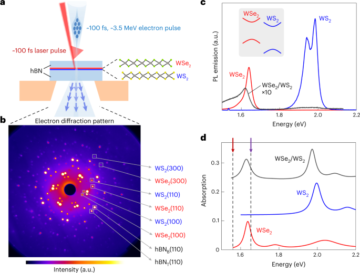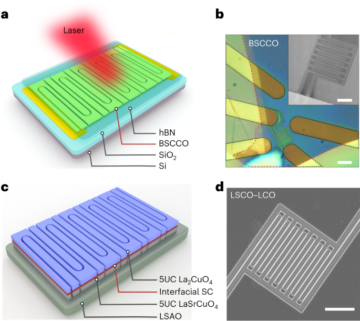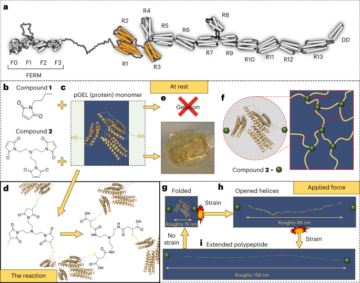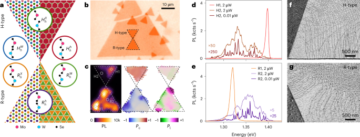
ثقافة ثنائية الأبعاد للخلايا الجذعية السرطانية المشتقة من الحبل السري
تم الحصول على الخلايا الجذعية السرطانية من الحبل السري (ucMSCs) من بنك أنتوني نولان للحبل، مقطعة إلى قطع صغيرة ومطلية في وسط قاعدي (أي αMEM + 1٪ v / v penicillin-streptomycin) تحتوي على 5٪ (v / v) من الصفائح الدموية البشرية ليساتي عند 37 درجة مئوية، 5% CO2. بعد إزالة الخلايا غير الملتصقة والغسيل باستخدام برنامج تلفزيوني، تم تجديد الوسائط وتم زراعة الخلايا حتى تصل إلى 70-90٪ من التقاء. تم بعد ذلك إجراء عملية التربسين لمزيد من التوصيف وتمرير الخلايا. تميزت ucMSCs بإيجابية CD90 و 105 و CD106 و CD73 ومستضد الكريات البيض البشرية من الدرجة الأولى وعدم وجود تعبير عن CD14 و CD31 و CD45. المقاطع المبكرة 1 × 106 تم زراعة ucMSCs (المقاطع 2-5) بشكل مستمر في مرشح يبلغ طوله 175 سم2 قارورة (كورنينج) في الوسائط القاعدية + 5% (حجم/حجم) محلول الصفائح الدموية البشرية. عندما وصلت الخلايا إلى 70٪ - 80٪ من التقاء، تم استبدال الوسائط بالوسط القاعدي قبل حصاد CCM في اليوم التالي لعزل EV والزراعة الفرعية بواسطة بروتوكول التربسين التقليدي.
ثقافة ثلاثية الأبعاد لـ ucMSCs
تم استخدام لوحة ثقافة ميكروويل Aggrewell400 لإنشاء الأجسام الشبه الكروية ucMSC باتباع بروتوكول تم إنشاؤه مسبقًا15. باختصار، تمت إضافة 500 ميكرولتر من محلول الشطف المضاد للالتزام إلى كل بئر قبل الطرد المركزي عند 2,000g لمدة دقيقتين لإزالة الفقاعات والحضانة لمدة 2 دقيقة إلى ساعتين في درجة حرارة الغرفة. تم بعد ذلك غسل Aggrewell باستخدام 30 ميكرولتر من PBS لكل بئر، متبوعًا بإضافة 2 ميكرولتر من الوسط القاعدي والطرد المركزي عند 500g لمدة دقيقتين لإزالة الفقاعات. تم بعد ذلك استبدال الوسط القاعدي بتعليق الخلية الذي تم الحصول عليه من التربسين ثنائي الأبعاد (المحضر بكثافة 2 × 25 خلايا لكل 500 ميكرولتر لكل بئر في الوسط القاعدي المضاف إلى 20% v/v KO استبدال المصل وفقًا لتعليمات الشركة المصنعة). ثم تم الطرد المركزي للوحة عند درجة حرارة 200g لمدة 5 دقائق لتجميع الخلايا في الجزء السفلي من كل microwell وإبقائها دون عائق في الحاضنة. تم حصاد CCM في اليوم 3 وكل 2-3 أيام لعزل EV. تم تجديد الوسط الطازج بعد الحصاد المتوسط للحفاظ على ثقافة ucMSC الكروية لمدة 12 يومًا.
عزل المركبات الكهربائية
تم إجراء عزل EV كما هو موضح بالتفصيل سابقًا46. تمت تعبئة أنابيب الطرد المركزي فائقة الوضوح من البولي كربونات (رقم الكتالوج 355631، Beckman Coulter) بـ 22.5 مل من CCM مفلتر (تم إعدادها عن طريق ترشيح CCM باستخدام مرشح حقنة 0.22 ميكرومتر). ثم 3 مل 25% وزن/وزن محلول سكروز (محضر في D2O) تم وضعه ببطء أسفل CCM باستخدام ماصة باستور زجاجية. تم إجراء الطرد المركزي باستخدام الدوار المتأرجح (SW32 Ti، Beckman Coulter) بسرعة 100,000g لمدة 1.5 ساعة عند 4 درجات مئوية. تم بعد ذلك جمع محلول السكروز (2 مل لكل أنبوب) وإخضاعه لخطوة غسيل لتنقية EV عن طريق إضافته إلى أنابيب الطرد المركزي الفائق من البولي كربونات المملوءة مسبقًا (رقم الكتالوج 355618؛ Beckman Coulter) مع 20 مل من PBS مفلتر قبل الطرد المركزي الفائق عند 100,000.g لمدة 1.5 ساعة عند 4 درجات مئوية باستخدام دوار ذو زاوية ثابتة (70 Ti، Beckman Coulter). تم التخلص من المادة الطافية وتم إعادة تعليق حبيبات EVs التي تم الحصول عليها في برنامج تلفزيوني تمت تصفيته. تم الاحتفاظ بالمركبات الكهربائية عند درجة حرارة 4 درجات مئوية للتخزين لمدة أسبوع واحد و-1 درجة مئوية للتخزين طويل المدى.
الكشف عن علامات EV بواسطة نقطة وصمة عار
تم إجراء التحليل باتباع بروتوكول منشور مسبقًا15. أولاً، 50 ميكرولتر من المركبات الكهربائية بتركيز 5 × 1010 تم رصد جزيئات لكل مل على غشاء النيتروسليلوز (غشاء واحد لكل علامة) (Bio-Rad). تم تجفيف الغشاء بغاز النيتروجين قبل خطوة الحجب باستخدام حاجز العازلة (أي 3٪ حليب خالي الدسم محضر في محلول ملحي تريس مع 0.1٪ توين 20 (TBS-T)) لمدة ساعة واحدة عند درجة حرارة الغرفة. تمت إضافة الأجسام المضادة الأولية (CD1، CD9، CD63 وTSG81) بشكل فردي في المخزن المؤقت للحظر الطازج متبوعًا بالحضانة طوال الليل عند 101 درجات مئوية (التخفيف 4: 1). تم بعد ذلك غسل الغشاء ثلاث مرات في TBS-T، لمدة 1,000 دقائق لكل غسلة. تمت بعد ذلك إضافة الجسم المضاد الثانوي المصاحب لبيروكسيداز الفجل إلى المخزن المؤقت الجديد قبل الحضانة الإضافية لمدة ساعة واحدة في درجة حرارة الغرفة (5: 1 لمضاد الفأر و1: 20,000 لمضاد الأرانب). تم غسل الغشاء كما ذكرنا سابقًا، وتم تطوير الإشارات عن طريق إضافة الركيزة (SuperSignal West Femto Maxim Sensitivity Substrate)، يليها التصوير باستخدام نظام Gel Doc (Bio-Rad) والتحليل بواسطة برنامج Image Lab (Bio-Rad).
فحص البروتين لتحديد تركيز البروتين للمركبات الكهربائية المعزولة
تم تحديد تركيزات البروتين عن طريق اختبار microBCA في لوحة 96 بئرًا باتباع إرشادات الشركة المصنعة التي تم تكييفها للمركبات الكهربائية. باختصار، عينات EV (الحد الأدنى للتركيز، 5 × 1010 تم تخفيف الجسيمات لكل مل) بنسبة 1: 1 في برنامج تلفزيوني. تمت إضافة مزيج كاشف MicroBCA (المحضر وفقًا لتعليمات الشركة المصنعة) لتكرار 40 ميكرولتر من العينات المخففة (50 ميكرولتر لكل بئر)، تليها الحضانة عند 37 درجة مئوية لمدة ساعة واحدة. تمت مقارنة القياس مع BSA المخفف بشكل تسلسلي كمعيار (تم إعداده في نسختين). تمت قراءة الامتصاص عند 1 نانومتر باستخدام قارئ لوحة FLUOStar Omega (BMG LabTech). تم استخدام برنامج MARS v.562 (BMG LabTech) للتحليل من خلال استقراء القيم من المنحنى القياسي باستخدام معادلة متعددة الحدود من الدرجة الثالثة، مع r2 > 0.999 لكل اختبار.
NTA
تم قياس حجم وتركيز EVs بواسطة NTA باستخدام Nanosight LM10 (Malvern Instruments) المجهز بالليزر 488 نانومتر. تم ضبط مستوى الكاميرا تلقائيًا، وتم ضبط عتبة اكتشاف التحليل على 3-4. تم تخفيف عينات EV في برنامج تلفزيوني مفلتر للحصول على التركيزات المثلى (20-80 جسيمًا لكل إطار). تم إجراء أربعة تسجيلات فيديو مدتها 40 ثانية لكل إعداد EV. تم استخدام برنامج Nanosight NTA 3.2 (Malvern Instruments) لتحليل الفيديو المسجل.
إمكانات زيتا
تم قياس الحركة الكهربية الديناميكية للمركبات الكهربائية ومركبات HC-EV باستخدام برنامج Malvern Zetasizer Nano ZS وZetasizer v.7.12 (Malvern Instruments). قبل القياسات، عينات EV (الحد الأدنى للتركيز، 1 × 1011 تم تخفيف الجسيمات لكل مل) بنسبة 1:50 في الماء منزوع الأيونات. أجريت القياسات عند 25 درجة مئوية لكل ثلاث نسخ تجريبية.
تحضير بروتين كورونا
تم إجراء طلاء بروتين كورونا بعد بروتوكول منشور47 مع التعديلات. لإزالة EVs ومصل البروتين المجمع، تعرض FBS للطرد المركزي الفائق عند 100,000g لمدة 18 ساعة عند 4 درجات مئوية. تم جمع المادة الطافية وتصفيتها من خلال مرشحات 0.22 ميكرومتر (EV-D FBS). المركبات الكهربائية (~7 × 1011 الجسيمات، أي ما يعادل 0.05 م2) تم تحضيرها بحجم إجمالي قدره 300 ميكرولتر من PBS معقم مكمل بمحلول البنسلين والستربتوميسين 1٪ (sPBS-PS) في أنابيب إيبندورف سعة 1.5 مل قبل الحضانة بـ 300 ميكرولتر EV-D FBS لمدة ساعة واحدة عند 1 درجة مئوية و 37 دورة في الدقيقة عند الحضانة، تم نقل الخليط إلى أنبوب الطرد المركزي الفائق (رقم الكتالوج 300، بيكمان كولتر). تم إجراء الطرد المركزي الفائق للعينات عند 343778g لمدة 1 ساعة عند 4 درجات مئوية. تمت إزالة الطاف بعناية دون إزعاج الحبيبات. تم غسل الحبيبة أيضًا باستخدام 1 مل sPBS-PS مرتين، بعد الحالة المذكورة أعلاه. في دراسات امتصاص الإكليل، عند الغسيل النهائي، تم تشتيت الحبيبة (HC-EVs) في 100 ميكرولتر 2٪ وزن / حجم SDS، 62.5 ملي مولار من محلول Tris-HCl، تليها الحضانة عند 95 درجة مئوية لمدة 5 دقائق للامتصاص. البروتينات التي تشكل HC. تم بعد ذلك فصل HC عن EVs بواسطة الطرد المركزي الفائق على النحو الوارد أعلاه. تم جمع المادة الطافية التي تحتوي على HC وإخضاعها لتقدير البروتين بواسطة اختبار microBCA. تم تخزين محاليل HC عند درجة حرارة -80 درجة مئوية قبل إجراء مزيد من التحليل.
الحزب الديمقراطي الصربي-الصفحة
تم خلط عينات EVs وHC-EVs وEV-D FBS وKO وHC (15 ميكروغرام) مع المخزن المؤقت لعينة LDS والمخزن المؤقت RIPA (ممزوجًا بكوكتيل مثبط الأنزيم البروتيني 1: 100) وحضنت لمدة 10 دقائق عند 70 درجة مئوية. تم بعد ذلك تطبيق العينات على هلام بروتين NuPAGE 4–12% Bis-Tris وتم تشغيلها لمدة 30 دقيقة عند 100 مللي فولت وساعة أخرى عند 1 مللي فولت. لتلطيخ الفضة، تم تثبيت الجل في محلول تثبيت 150 مل (100٪ ميثانول، 50٪ حمض أسيتيك، 10 ميكرولتر فورمالدهايد) طوال الليل، يليه الغسيل باستخدام 50٪ إيثانول ثلاث مرات. تم بعد ذلك تحسس الجل بمحلول نقص السكر (50% وزن/حجم ثيوكبريتات الصوديوم) لمدة دقيقة واحدة، يليه تشريب الجل بمحلول 0.02% وزن/حجم نترات الفضة لمدة 1 دقيقة. تم بعد ذلك غسل الجل بالماء منزوع الأيونات ثلاث مرات وإخضاعه لتطوير النطاق باستخدام محلول تطوير 0.2 مل (30 جم من كربونات الصوديوم، 100 مل من محلول نقص السكر في الدم و6 ميكرولتر من الفورمالديهايد). بمجرد تطويره، تم إيقاف التفاعل بنسبة 2% حجم/حجم حمض أسيتيك. تم التقاط صورة رقمية للجيل على خلفية بيضاء.
هضم بروتين كورونا لتحليل قياس الطيف الكتلي
تم إجراء التحليل البروتيني لبروتينات FBS وEVs وHC بواسطة LC-MS باستخدام الطريقة الموصوفة بواسطة Schottler et al.47. باختصار، تمت إزالة SDS من العينات بواسطة أعمدة إزالة منظف بيرس، وتم ترسيب 25 ميكروغرام من كل عينة بروتين بواسطة مجموعة ترسيب البروتين ProteoExtract وفقًا لدليل الشركة المصنعة. تمت إعادة تعليق كريات البروتين الناتجة في 0.1٪ RapiGest SF في 50 ملي مولار من بيكربونات الأمونيوم واحتضانها لمدة 15 دقيقة عند 80 درجة مئوية. تمت إضافة Dithiothreitol (التركيز النهائي، 5 مم) لتقليل البروتينات، وتم تحضين الخليط عند 56 درجة مئوية لمدة 45 دقيقة. تمت بعد ذلك إضافة Iodoacetamide (التركيز النهائي، 15 مم)، وتم تحضين الخليط أيضًا في الظلام لمدة ساعة واحدة عند درجة حرارة الغرفة. تم هضم عينات البروتين لمدة 1 ساعة عند 18 درجة مئوية بواسطة التربسين مع نسبة إنزيم: بروتين تبلغ 37:1 (وزن / وزن). تم إيقاف التفاعل بإضافة 50 ميكرولتر من حمض الهيدروكلوريك. تم تخفيف الببتيدات المهضومة باستخدام حمض الفورميك بنسبة 2% حجم/حجم في ماء درجة UPLC-MS وتم رفعها بـ 0.1 فمول ميكروليتر.-1 Hi3 كولاي معيار القياس الكمي المطلق.
في الامتصاص الخلوي المختبري للمركبات الكهربائية ومركبات HC-EV
EV2D و إيف3D تم تصنيفها وفقًا لبروتوكولنا المنشور48. تم الحصول على التركيز في الجزيئات لكل مل بواسطة NTA كما هو مذكور أعلاه. تم قياس شدة التألق للمركبات الكهربائية الطازجة (100 ميكرولتر) باستخدام قارئ لوحة FLUOStar Optima (BMG Labtech)، مع أطوال موجية للإثارة والانبعاث تبلغ 485 نانومتر و520 نانومتر، على التوالي. عندما يكون هناك اختلاف في كفاءة وضع العلامات بين الدُفعات أو أنواع المركبات الكهربائية، تم خلط العينات مع المركبات الكهربائية غير الموسومة بحيث تكون كثافة الفلورسنت وأرقام الجسيمات قابلة للمقارنة بالنسبة للعينات المختلفة. تم زرع الخلايا البلعمية، أي J774 والخلايا البلعمية المشتقة من الخلايا الأحادية البشرية، والخلايا غير البلعمية، أي HepG2، بكثافة 1.5 × 105 الخلايا لكل بئر في 24 لوحة جيدا (كورنينج). بعد 24 ساعة، تم تغيير الوسائط إلى وسائط خالية من المصل، وتم علاج الخلايا بالمسمى EV2D، HC-EV2D، إيف3D وHC-EV3D من قيم وحدة مضان قابلة للمقارنة وجرعة 2 × 109 الجسيمات واحتضانها لمدة ساعة، 1 ساعات، و 4 ساعة. لتقييم مساهمة مستقبلات ربط الزلال في التوسط في استيعاب EV ، عولجت خلايا HepG24 بـ BSA (2 مجم مل )-1)، متبوعًا بإضافة EV المسمى DiD3D، لمدة 24 ساعة. تم إجراء قياس التدفق الخلوي على BD FACSCalibur باستخدام برنامج BD FACStation v.6.0 (BD Biosciences) على الخلايا المنفصلة بواسطة التربسين – EDTA 0.05٪، وتم غسلها وإعادة تعليقها في 200 ميكرولتر من PBS. تم تحليل جميع العينات باستخدام FlowJo v.10.7.2 (TreeStar/BD Bioscience). تم بوابات الخلايا من خلال مبعثرها الأمامي والجانبي. تم تقييم امتصاص المركبات الكهربائية بواسطة MFI في Alexa Fluor 488. وتم حساب التغير الطي في MFI فيما يتعلق بزيادة MFI النسبية على عناصر التحكم غير المعالجة.
أشكال حيوانات
تم إجراء جميع التجارب على الحيوانات وفقًا لقانون المملكة المتحدة بشأن الحيوانات (الإجراءات العلمية) لعام 1986 ومدونة ممارسات وزارة الداخلية في المملكة المتحدة لإسكان ورعاية الحيوانات المستخدمة في الإجراءات العلمية (وزارة الداخلية 1989). التزمت التجارب في الجسم الحي بترخيص المشروع المعتمد من هيئة رعاية الحيوان والمراجعة الأخلاقية في كينجز كوليدج لندن (AWERB) ووزارة الداخلية في المملكة المتحدة (PBE6EB195 وPP8950634). تم إجراء البحوث الحيوانية والرعاية البيطرية في مبنى فرانكلين ويلكنز، كلية كينغز لندن بموجب البروتوكول المعتمد لهذه الدراسة من قبل موظف التدريب والكفاءة المسمى (جولي كيبل) وموظف رعاية ورعاية الحيوان المسمى (جين مورغان). تم الحصول على الفئران الأنثوية CD-1 (حوالي 25-35 جم، عمرها 5 أسابيع) من نهر تشارلز لإجراء دراسة التوزيع الحيوي في الجسم الحي. تم الحصول على فئران ذكور وإناث C57BL/6 (18-25 جم، عمر 6-8 أسابيع) من نهر تشارلز لإجراء دراسة الامتصاص الخلوي في الجسم الحي. تم إيواء جميع الفئران في دورة مظلمة لمدة 12 ساعة / 12 ساعة مع الحفاظ على درجة الحرارة بين 65 و 75 درجة فهرنهايت (~18-23 درجة مئوية) و ~50% رطوبة. تم استخدام كلا الجنسين في الدراسة، امتثالا للتوصيات التي نشرها مؤخرا مجلس البحوث الطبية في المملكة المتحدة لإجراء البحوث على الحيوانات.
التوزيع الحيوي للمركبات الكهربائية في الجسم الحي عن طريق التصوير البصري الفلوري
تم تحضين CCM المصفى باستخدام 1 ميكرومتر من متتبع الفلورسنت المحب للدهون DiR (1,1،3,3,3,3-ديوكتاديسيل-1،1،XNUMX،XNUMX-يوديد رباعي ميثيل ليندوتريكاربوسيانين) في درجة حرارة الغرفة لمدة ساعة واحدة مع التحريض قبل عزل EV بواسطة وسادة السكروز بالإضافة إلى الطرد المركزي الفائق كما هو موضح أعلاه إزالة الصبغة غير منضم. تم إجراء التجربة على فئران CDXNUMX، وتم تقسيمها عشوائياً إلى مجموعات. EV المنقى حديثًا والذي يحمل علامة DiR2D و إيف3D (2 × 1011 تم حقن جزيئات في 200 ميكرولتر) عن طريق الوريد عن طريق الوريد الذيل. تم حقن فئران التحكم باستخدام برنامج تلفزيوني فقط أو برنامج تلفزيوني يحتوي على DiR. تم تصوير الفئران الحية المسكنة بالإيزوفلوران باستخدام نظام IVIS Lumina III (الإثارة، 740 نانومتر؛ الانبعاث، 840 نانومتر) عند 1 و4 و24 ساعة بعد الحقن في الوريد قبل قتل الحيوانات. تم حصاد الأعضاء الرئيسية (الدماغ والقلب والرئة والكبد والمعدة والطحال والكلى والأمعاء) لتصوير مضان خارج الجسم الحي. تم الحصول على شدة التألق في كل عضو (الكفاءة الإشعاعية الكلية) باستخدام برنامج Living Image v.4.7.3 (PerkinElmer) لتحديد التوزيع الحيوي للأعضاء لـ EV المسمى DiR2D و إيف3D عن طريق رسم المناطق ذات الاهتمام (ROIs) لكل عضو. تم بعد ذلك تطبيع القيم لأوزان الأعضاء (إجمالي الكفاءة الإشعاعية لكل جرام). بالنسبة لدراسة تصفية الكلى، عند الحقن باستخدام EVs المسمى DiR، تم إيواء الفئران بشكل فردي في قفص استقلابي دائري قياسي (Nalgene Nunc) لمدة 24 ساعة، وتم جمع البول في أنبوب Nalgene في الجزء السفلي من نظام القمع لمزيد من التألق تحديد الكثافة باستخدام نظام IVIS Lumina III وبرنامج Living Image v.4.7.3 (PerkinElmer) عن طريق رسم عائد الاستثمار الذي يغطي حاوية البول للحصول على كفاءة إشعاعية إجمالية لكل عينة بول.
في امتصاص الخلايا الحية من EVs في مجموعات سكانية فرعية من الكبد
EV2D و إيف3D تم تصنيفها بـ DiD (DiIC18 (5)؛ 1,1،3,3,3′-ديوكتاديسيل-3،4،57′،6′-رباعي ميثيل ليندوديكاربوسيانين، ملح XNUMX-كلورو بنزين سلفونات) باستخدام نفس الإجراء المتبع في وضع العلامات على DiR في الدراسات المجراة. تم إجراء التجربة على فئران CXNUMXBL/XNUMX، وتم تقسيمها عشوائيًا إلى مجموعات. EV المنقى حديثًا والذي يحمل علامة DiD2D و إيف3D (2 × 1011 تم حقن جزيئات في 200 ميكرولتر) عن طريق الوريد عبر الوريد الذيل. تم حقن فئران التحكم باستخدام برنامج تلفزيوني فقط أو برنامج تلفزيوني يحتوي على DiD. لدراسة حجب مستقبلات الألبومين، تم تخفيف 100 ميكرولتر من BSA في برنامج تلفزيوني (10 ملغ مل-1الجرعة المختارة على أساس الأدب49,50,51,52) تم حقنه قبل 5 دقائق من EV3D الحقن (2 × 1011 جزيئات في 100 ميكرولتر). لدراسة استيعاب EV المغلفة بالألبومين، لإعداد EV المغلفة بالألبومين والمسمى DiD2D، تم استزراع ucMSCs ثنائي الأبعاد (2-70٪ تطابق) في وسط قاعدي مكمل بـ 80 مجم مل-1 BSA، تليها مجموعة متوسطة بعد 24 ساعة من الثقافة، ووضع العلامات DiD وعزل EV كما ذكرنا سابقًا. EV المسمى DiD المغطى بالزلال2D ثم يتم حقنها عن طريق الوريد (2 × 1011 جزيئات في 200 ميكرولتر). بعد أربع وعشرين ساعة، تم تخدير الفئران بالفينوباربيتال وإخضاعها لتشريح الجلد على خط الوسط البطني لفتح التجويف البريتوني لتروية الكبد بعد البروتوكول المنشور مسبقًا مع التعديلات53. تم إشباع الفئران بـ 30 مل من HBSS-EGTA تم تسخينها عند 41 درجة مئوية من خلال الوريد الأجوف السفلي باستخدام مضخة تمعجية (SciQ 300، Watson Marlow) ومجموعة ضخ مجنحة 27G × 0.38 ″ × 12 ″ (BD Valu-Set) عند سرعة 15 دورة في الدقيقة تم قطع الوريد البابي الكبدي بعد أن أصبح الكبد منتفخًا وتغير لونه، وبعد ذلك تم تعديل السرعة إلى 20 دورة في الدقيقة ثم تم إرواء الفئران بـ 25 مل من HBSS-CaCl المحتوي على كولاجيناز2 (تركيز 1 ملجم مل-1) تم تسخينه عند 41 درجة مئوية، بسرعة 15 دورة في الدقيقة، تم نقل الكبد إلى طبق بتري يحتوي على HBSS-CaCl البارد2 متعادل. تم إطلاق الخلايا الكبدية عن طريق كسر كبسولة جليسون بلطف وهز الكبد. عند الحصول على تعليق خلية متجانس، تم ترشيح الخلايا من خلال مصفاة 70 ميكرومتر (كورنينج). تم فصل خلايا الكبد بواسطة الطرد المركزي لمدة 3 دقائق عند 50g عند 4 درجات مئوية مع فرامل منخفضة، ثلاث دورات. بعد كل دورة، تم إعادة تعليق الحبيبة في 30 مل من HBSS-CaCl البارد2، وتم جمع الطاف لمزيد من تجزئة NPC. تم تكوير جزء NPC عند 650g عند 4 درجات مئوية وتعرض للحضانة مع عازلة تحلل RBC لمدة 5 دقائق على الجليد، تليها إضافة 20 مل PBS لوقف التفاعل ومزيد من الطرد المركزي عند 650 درجة مئوية.g عند 4 درجات مئوية لتكوير جزء المجلس الوطني لنواب الشعب الصيني المنقى. تم إجراء تحديد كل مجموعة سكانية فرعية بناءً على تعبير العلامة باستخدام الأجسام المضادة ذات العلامات الفلورية للتحليل عن طريق قياس التدفق الخلوي (BD FACSCelesta، الذي يديره برنامج BD FACSDiva v.9.2، وBD Biosciences) وبرنامج FlowJo v.10.7.2 (TreeStar/BD Bioscience). ). تم تلوين خلايا الكبد بالأجسام المضادة ASGPR1 المضادة للفأر (1: 200)54,55,56 وCD9 المضادة للإنسان عن طريق تلطيخ الخلايا باستخدام 0.1% Triton-X 100 في برنامج تلفزيوني. تم تلوين خلايا كوبفر باستخدام CD45 وF4-80 وCD11b المضادة للفأر (1: 200 لكل منهما).57,58,59. تم تلوين الخلايا البطانية باستخدام CD45 المضاد للفأر (1:200)، وCD31 (1:200)، وCD146 (1:100).60,61,62. تم تلوين الخلايا النجمية باستخدام CD45 المضاد للفأر (1:200) وGFAP (1:50) وتم اكتشافها باستخدام مرشح 450/50 وليزر بنفسجي بطول 405 نانومتر.63,64,65. كانت جميع الكسور ملطخة بـ Zombie Aqua لتحديد مدى صلاحية الخلايا. تم إجراء تلطيخ لمدة 30 دقيقة في درجة حرارة الغرفة. تم تحديد تواتر الخلايا الأم التي تتناول EVs عن طريق ربط مجموعة الخلايا الإيجابية DiD ضد مجموعة التحكم (PBS). تم استخدام مؤسسات التمويل الأصغر الخاصة بإشارة DiD التي يعبر عنها كل نوع من الخلايا لتقييم كمية امتصاص المركبات الكهربائية.
تحليل احصائي
تم إجراء التحليلات الإحصائية للبيانات باستخدام Prism 9.4.1 (برنامج GraphPad) باستخدام تحليل التباين أحادي الاتجاه (ANOVA) مع اختبار Tukey اللاحق للجميع P قيم (*P <0.05، **P <0.01، ***P <0.001 ، ****P <0.0001 ؛ P > 0.05 كان غير مهم). يتم التعبير عن جميع النتائج على أنها متوسط ± sd وكان من المفترض أن يكون توزيع البيانات طبيعيًا ولكن لم يتم اختبار ذلك رسميًا. لم يتم استخدام أي طرق إحصائية لتحديد أحجام العينات مسبقًا، ولكن تم اختيار أحجام العينات بناءً على تجارب سابقة أجرتها مجموعتنا بالمثل مع تأثيرات ذات دلالة إحصائية مثبتة10. تم إجراء جميع الرسوم البيانية في بريزم 9.4.1. تم استخدام MATLAB 9.11 لإنشاء خرائط حرارية للبيانات. لم يتم إجراء جمع البيانات وتحليلها بشكل أعمى لظروف التجارب. تم تضمين كافة نقاط البيانات للتحليلات.
ملخص التقارير
مزيد من المعلومات حول تصميم البحوث متاح في ملخص تقارير حافظة الطبيعة مرتبطة بهذه المادة.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://www.nature.com/articles/s41565-023-01585-y
- :يكون
- :ليس
- ] [ص
- $ UP
- 000
- 001
- 01
- 05
- 1
- 10
- 100
- 11
- 12
- 15%
- 150
- 16
- 175
- 1996
- 2%
- 20
- 200
- 2000
- 2010
- 2011
- 2013
- 2015
- 2016
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 24
- 25
- 2D
- 30
- 300
- 35%
- 4
- 40
- 41
- 45
- 46
- 48
- 5
- 50
- 500
- 52
- 54
- 58
- 6
- 62
- 65
- 7
- 70
- 75
- 80
- 89
- 9
- a
- فوق
- مطلق
- وفقا
- بدقة
- كسب
- عمل
- تكيف
- وأضاف
- مضيفا
- إضافة
- تم الالتزام
- تعديل
- تدار
- بعد
- ضد
- مجمعة
- تجميع
- AL
- اليكسا
- الكل
- am
- كمية
- an
- تحليل
- تحليل
- تحليل
- مرساة
- و
- حيوان
- الحيوانات
- أنتوني
- الأجسام المضادة
- الجسم المضاد
- مولد المضاد
- تطبيقي
- من وزارة الصحة
- أكوا
- هي
- البند
- AS
- يفترض
- At
- تلقائيا
- متاح
- b
- خلفية
- سوار الساعة
- مصرف
- على أساس
- BD
- BE
- وأصبح
- قبل
- أقل من
- ما بين
- المؤشرات الحيوية
- أعمى
- حجب
- الجسدي
- على حد سواء
- الملابس السفلية
- دماغ
- كسر
- موجز
- BSA
- العازلة
- ابني
- لكن
- by
- محسوب
- وكاميرا
- السرطان.
- الخلايا السرطانية
- قادر على
- الطاقة الإنتاجية
- يهمني
- بعناية
- نفذت
- الخلية
- خلايا
- خلوي
- تغيير
- غير
- تتميز
- تشارلز
- اختيار
- دائري
- فئة
- تخليص
- انقر
- كوكتيل
- الكود
- بارد
- جمع
- مجموعة شتاء XNUMX
- كلية
- الأعمدة
- مماثل
- مقارنة
- الالتزام
- الامتثال
- من التركيز
- حالة
- الشروط
- أجرت
- إجراء
- كونولي
- وعاء
- بشكل متواصل
- إسهام
- مراقبة
- ضوابط
- تقليدي
- حبل
- إكليل
- مجلس
- تغطية
- ثقافة
- منحنى
- قطع
- دورة
- غامق
- البيانات
- نقاط البيانات
- يوم
- أيام
- de
- تعريف
- التوصيل
- كثافة
- تابع
- وصف
- تصميم
- التفاصيل
- الكشف عن
- كشف
- تقرير
- حدد
- مصمم
- تحديد
- المتقدمة
- تطوير
- التطوير التجاري
- فعل
- فرق
- مختلف
- رقمي
- المخفف
- والتخفيف
- التخلص منها
- طبق
- مشتت
- خامد
- توزيع
- منقسم
- DOE
- جرعة
- جرعة
- رسم
- التكرارات
- مدة الأقامة
- أثناء
- ديناميكي
- اختلال وظيفي
- e
- E & T
- كل
- في وقت مبكر
- تأثير
- الآثار
- الكفاءات
- كفاءة
- انبعاث
- تمكين
- تعزيز
- يعزز
- معادلة
- مسلح
- معادل
- أنشئ
- الأثير (ETH)
- أخلاقي
- EV
- تقييم
- تقييم
- تقييم
- كل
- EVS
- تجربة
- تجريبي
- تجارب
- أعربت
- التعبير
- أنثى
- معبأ
- تصفية
- تصفية
- مرشحات
- نهائي
- الاسم الأول
- ثابت
- تدفق
- يتبع
- متابعيك
- في حالة
- الفورمالديهايد
- رسميا
- تشكيل
- إلى الأمام
- أربعة
- جزء
- FRAME
- تردد
- جديد
- تبدأ من
- وظيفة
- وظيفيا
- إضافي
- GAS
- عن طريق بوابة
- النابضة
- توليد
- لطيف
- زجاج
- درجة
- الرسوم البيانية
- تجمع
- مجموعات
- اﻟﺤﺼﺎد
- قلب
- الصفحة الرئيسية
- وزارة الداخلية
- ساعات العمل
- إسكان
- HTTPS
- الانسان
- i
- ICE
- هوية
- يحدد
- ثالثا
- صورة
- التصوير
- المناعي
- حصانة
- مناعي
- in
- شامل
- القيمة الاسمية
- محتضن
- احتضان
- التحضين
- حاضنة
- بشكل فردي
- الحث
- التهاب
- التهابي
- معلومات
- صب
- تعليمات
- الصكوك
- تفاعل
- مصلحة
- إلى
- وريدي
- عن طريق الوريد
- معزول
- عزل
- أبقى
- الكلى
- قتل
- عدة
- مختبر
- وسم
- نقص
- تفتقر
- الليزر
- الى وقت لاحق
- الطبقات
- مستوى
- حقوق الملكية الفكرية
- حدود
- LINK
- مرتبط
- حي
- كبد
- الذين يعيشون
- لندن
- طويل الأجل
- منخفض
- لومينا
- الضامة
- صنع
- المحافظة
- حافظ
- رائد
- ذكر
- كتيب
- علامة
- المريخ
- كتلة
- مادة
- أقصى
- تعني
- قياس
- قياس
- قياسات
- الوسائط
- طبي
- البحوث الطبية
- متوسط
- المذكورة
- الأيض
- الميثانول
- طريقة
- طرق
- كانت الأساليب
- فأره
- هجرة
- الحليب
- دقيقة
- الحد الأدنى
- قاصر
- مزيج
- مختلط
- مزيج
- ML
- التنقل
- التعديلات
- MOL
- مورغان
- فأر
- عين
- نانو
- تكنولوجيا النانو
- الطبيعة
- لا
- عادي
- عدد
- أرقام
- تحصل
- تم الحصول عليها
- الحصول على
- of
- Office
- امين شرطة منزل فؤاد
- قديم
- on
- مرة
- ONE
- فقط
- جاكيت
- تعمل
- بصري
- الأمثل
- or
- لنا
- خارج
- على مدى
- بين عشية وضحاها
- المقاطع
- نظام
- إلى
- تنفيذ
- بتري
- السمات الظاهرية للنباتات
- قطعة
- ثقب
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- المزيد
- نقاط
- متعدد الحدود
- سكان
- بوابة
- محفظة
- الإيجابية
- منشور
- ممارسة
- إعداد
- أعدت
- سابق
- سابقا
- ابتدائي
- قبل
- الإجراءات
- الإجراءات
- تنفيذ المشاريع
- تكاثر
- تعزيز
- حماية
- الحماية والوقاية
- بروتين
- البروتينات
- بروتوكول
- ثبت
- نشرت
- مضخة
- تحديد الكميات
- R
- مشع
- نسبة
- RBC
- التي تم الوصول إليها
- الوصول إلى
- رد فعل
- عرض
- قارئ
- مؤخرا
- المتلقي
- ساندي خ. ميليك
- مسجل
- تخفيض
- مرجع
- تعكس
- المناطق
- المنظمين
- نسبي
- صدر
- إزالة
- إزالة
- إزالة
- كلوي
- استبدال
- إستبدال
- التقارير
- مطلوب
- بحث
- احترام
- مما أدى
- النتائج
- عائد
- مراجعة
- نهر
- غرفة
- يجري
- s
- ملح
- نفسه
- عينة
- اصابات النخاع الشوكي
- علمي
- ثانوي
- مختار
- اختيار
- حساسية
- تعفن الدم
- سيروم
- طقم
- جانب
- سيجنل
- إشارات
- هام
- فضي
- وبالمثل
- عزباء
- المقاس
- الأحجام
- المقشود
- بيج
- ببطء
- صغير
- So
- صوديوم
- تطبيقات الكمبيوتر
- حل
- الحلول
- سرعة
- غزل
- يدور
- معيار
- إحصائي
- إحصائيا
- الشبح الأسود
- جذع
- الخلايا الجذعية
- خطوة
- قلة النوم
- توقف
- تخزين
- تخزين
- دراسات
- دراسة
- الركيزة
- المساحة
- تعليق
- نظام
- T
- اتخذت
- مع الأخذ
- استهداف
- تجربه بالعربي
- اختبار
- أن
- •
- المملكة المتحدة
- من مشاركة
- then
- هناك.
- ثلاثة
- ثلاثي الأبعاد
- عتبة
- عبر
- مرات
- إلى
- الإجمالي
- مرسمة
- قادة الإيمان
- نقل
- المعالجة
- مرتين
- اثنان
- نوع
- أنواع
- Uk
- مع
- وحدة
- حتى
- بناء على
- امتصاص
- مستعمل
- استخدام
- القيم
- طبيب بيطري
- بواسطة
- بقاء
- فيديو
- vivo
- حجم
- وكان
- غسل
- مياه
- واتسون
- موجات
- أسبوع
- أسابيع
- خيرية
- حسن
- كان
- West Side
- ويلر
- متى
- التي
- أبيض
- مع
- في غضون
- بدون
- عائدات
- زفيرنت
- الاموات الاحياء