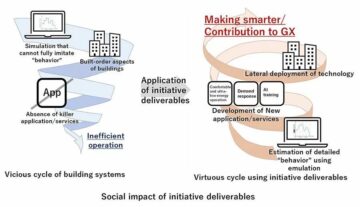
طوكيو ، 19 يناير 2022 - (JCN Newswire) - أعلنت شركة Eisai المحدودة اليوم أن وحدة تجارب شبكة الزهايمر الموروثة (DIAN-TU) ، بقيادة كلية الطب بجامعة واشنطن في سانت لويس ، قد سجلت أول مركز موضوع في دراسة المرحلة الثانية / الثالثة (دراسة Tau NexGen). ستقيم الدراسة تأثير الجسم المضاد تاو E2814 في منطقة الارتباط المضاد للأنابيب الدقيقة (MTBR) في مرض الزهايمر الوراثي السائد (DIAD).
من المعروف أن الأشخاص الذين لديهم طفرات جينية في DIAD يصابون بمرض الزهايمر (AD) ومن المرجح أن تظهر عليهم الأعراض في نفس العمر الذي أصيب به آباؤهم المصابون ، غالبًا في الخمسينيات أو الأربعينيات أو حتى الثلاثين. أمراض الزهايمر الرئيسية هي لوحة أميلويد التي تتكون من تكتلات أميلويد بيتا (أبيتا) ؛ التشابك الليفي العصبي؛ والتجمعات العصبية من تاو ، والتي يعتقد أنها تنتشر في جميع أنحاء الدماغ.
الغرض من دراسة Tau NexGen هو تقييم السلامة والتحمل والعلامات الحيوية والفعالية المعرفية للعلاجات الاستقصائية في المشاركين قبل الأعراض أو الذين يعانون من أعراض والذين لديهم طفرة جينية مسببة لمرض الزهايمر. في مارس 2021 ، اختارت DIAN-TU E2814 ، الذي تم إنشاؤه من خلال تعاون بحثي بين Eisai و University College London ، كأول طب تحقيقي بين الأدوية المضادة لـ tau لدراسة Tau NexGen. مع تزايد الأدلة من الدراسات السريرية التي تظهر أن استهداف الأميلويد يمكن أن يقلل من المؤشرات الحيوية لمرض الزهايمر ، اختار قادة التجارب السريرية Tau NexGen الأجسام المضادة المضادة للألياف البروتينية من Eisai (BAN2401) كعلاج مضاد للأميلويد ، وتم تعديل تصميم الدراسة في نوفمبر 2021.
يضع إيساي علم الأعصاب كمجال علاجي رئيسي ، وسيستمر في خلق الابتكار في تطوير الأدوية الجديدة بناءً على أحدث أبحاث علم الأعصاب حيث يسعى إلى المساهمة بشكل أكبر في تحسين فوائد الأفراد المتضررين وأسرهم في الأمراض التي لم يتم تلبيتها بشكل كبير. الاحتياجات ، مثل الخرف بما في ذلك الزهايمر.
حول شبكة الزهايمر الموروثة (DIAN)
DIAN هو جهد بحثي دولي يركز على مرض الزهايمر الوراثي السائد. مرض الزهايمر الوراثي السائد (DIAD) هو شكل نادر من مرض الزهايمر (AD) الذي يسبب فقدان الذاكرة والخرف لدى الأفراد - عادة عندما يكونون في الثلاثينيات إلى الخمسينيات من العمر. يصيب المرض أقل من 30٪ من إجمالي السكان المصابين بمرض الزهايمر. الهدف من وحدة تجارب شبكة الزهايمر الموروثة (DIAN-TU) هو إيجاد حلول لعلاج أو الوقاية من هذا المرض ، وربما جميع أشكال مرض الزهايمر. DIAN-TU هي شراكة دولية بين القطاعين العام والخاص مكرسة لتصميم وإدارة التجارب العلاجية التداخلية للأفراد المصابين والمعرضين لخطر الإصابة بـ DIAD.
حول دراسة Tau NexGen
الغرض من دراسة Tau NexGen هو تقييم السلامة والتحمل والعلامات الحيوية والفعالية المعرفية للعلاجات الاستقصائية لدى الأشخاص الذين لديهم طفرة جينية تسبب مرض الزهايمر. في دراسة Tau NexGen ، سيتم إعطاء المشاركين الذين يعانون من أعراض الأجسام المضادة بيتا أميلويد (Abeta) بروتوفيبريل lecanemab لمدة ستة أشهر قبل أن يتم تعيينهم بشكل عشوائي لتلقي أيضًا عقار مضاد تاو أو دواء وهمي. نظرًا لأن لويحات الأميلويد تتراكم قبل تشابك تاو في ميلادي ، فإن تصميم الدراسة هذا يسمح للباحثين بتقييم ما إذا كان إزالة الأميلويد يمهد الطريق لعقار مضاد تاو للعمل بشكل أكثر فعالية. سيتم تعيين المشاركين قبل ظهور الأعراض بشكل عشوائي لتلقي عقار مضاد تاو أو دواء وهمي لمدة عام قبل بدء إدارة ليكانيماب. من خلال ترتيب الأدوية بهذه الطريقة ، سيتمكن الباحثون من تقييم تأثيرات الدواء المضاد تاو وحده قبل تقييم تأثيرات العقارين معًا. إذا كانت نقاط النهاية الأولية والثانوية إيجابية في التحليل بعد عامين من بدء الدراسة ، فسيتم تمديد الدراسة لمدة عامين آخرين لتقييم ما إذا كان الدواء يبطئ التدهور المعرفي وله تأثيرات أخرى على علم أمراض تاو.
حول E2814
يتم تطوير الجسم المضاد تاو لمنطقة ربط الأنابيب الدقيقة (MTBR) ، E2814 كعامل تعديل للمرض لاعتلالات تاووباتت بما في ذلك مرض الزهايمر المتقطع. المرحلة الأولى من الدراسات السريرية جارية. تم اكتشاف E2814 كجزء من التعاون البحثي بين Eisai و University College London. تم تصميم E2814 لمنع انتشار بذور تاو داخل أدمغة الأفراد المصابين.
حول Lecanemab (BAN2401)
Lecanemab هو جسم مضاد أحادي النسيلة متوافق مع البشر لمرض الزهايمر نتيجة لتحالف بحثي استراتيجي بين Eisai و BioArctic. يرتبط Lecanemab بشكل انتقائي لتحييد وإزالة مجاميع Abeta السامة القابلة للذوبان (الألياف الأولية) التي يُعتقد أنها تساهم في عملية التنكس العصبي.
في الإعلان. على هذا النحو ، قد يكون لليكانيماب القدرة على التأثير على علم أمراض المرض وإبطاء تقدم المرض. فيما يتعلق بالنتائج من التحليل المحدد مسبقًا في 18 شهرًا من العلاج ، أظهرت الدراسة 201 انخفاض تراكم Abeta في الدماغ (P <0.0001) وإبطاء تطور المرض المقاس بواسطة ADCOMS * (P <0.05) في أوائل الأشخاص المصابين بمرض الزهايمر. لم تحقق الدراسة قياس النتيجة الأولية ** في 12 شهرًا من العلاج. بدأ تمديد التسمية المفتوحة في الدراسة 201 بعد الانتهاء من الفترة الأساسية وفترة التوقف عن العلاج (متوسط 24 شهرًا) لتقييم السلامة والفعالية ، وهي جارية.
حصلت Eisai على الحقوق العالمية لدراسة وتطوير وتصنيع وتسويق lecanemab لعلاج AD وفقًا لاتفاقية أبرمت مع BioArctic في ديسمبر 2007. في مارس 2014 ، دخلت Eisai و Biogen في اتفاقية تطوير وتسويق مشتركة لـ lecanemab والأطراف عدل هذا الاتفاق في أكتوبر 2017. حاليًا ، تتم دراسة lecanemab في دراسة سريرية محورية من المرحلة الثالثة في أعراض مبكرة لمرض الزهايمر (Clarity AD) ، بعد نتائج المرحلة الثانية من الدراسة السريرية (الدراسة 201). في يوليو 2020 ، بدأت الدراسة السريرية للمرحلة الثالثة (AHEAD 3-45) للأفراد المصابين بمرض الزهايمر قبل السريري ، مما يعني أنهم طبيعيون سريريًا ولديهم مستويات متوسطة أو مرتفعة من الأميلويد في أدمغتهم. يتم إجراء AHEAD 3-45 كشراكة بين القطاعين العام والخاص بين اتحاد التجارب السريرية لمرض الزهايمر الذي يوفر البنية التحتية للتجارب السريرية الأكاديمية في مرض الزهايمر والخرف المرتبط به في الولايات المتحدة ، بتمويل من المعهد الوطني للشيخوخة ، وهو جزء من المعاهد الوطنية للصحة ، وإيساي.
في سبتمبر 2021 ، تم البدء في تقديم طلب متجدد إلى إدارة الغذاء والدواء (FDA) لطلب ترخيص علم الأحياء (BLA) لعلاج مرض الزهايمر المبكر في إطار مسار الموافقة المعجل. تم منح Lecanemab لقب علاج الاختراق في يونيو 2021 ، وهو برنامج من إدارة الغذاء والدواء الأمريكية (FDA) يهدف إلى تسريع تطوير ومراجعة الأدوية للظروف الخطيرة أو التي تهدد الحياة.
* تم تطوير ADCOMS (AD Composite Score) من قبل Eisai ، ويجمع بين عناصر من ADAS-Cog (مقياس فرعي معرفي لتقييم مرض الزهايمر) و CDR (تصنيف الخرف السريري) و MMSE (فحص الحالة العقلية المصغر) لتمكين الكشف الحساس التغيرات في الوظائف السريرية لأعراض مبكرة والتغيرات في الذاكرة.
** احتمال تقديري بنسبة 80٪ أو أعلى لإثبات تباطؤ بنسبة 25٪ أو أكثر في التدهور السريري خلال 12 شهرًا من العلاج الذي تم قياسه بواسطة ADCOMS من خط الأساس مقارنةً بالدواء الوهمي
استفسارات وسائل الإعلام:
قسم العلاقات العامة ، Eisai Co.، Ltd.
+81-(0)3-3817-5120
شركة إيساي (الولايات المتحدة) ليبي هولمان 201-753-1945
Libby_Holman@eisai.com
مستثمر الاتصال:
Eisai المحدودة
قسم علاقات المستثمرين
TEL: +81-(0)70-8688-9685
حقوق النشر 2022 JCN Newswire. كل الحقوق محفوظة. www.jcnnewswire.com أعلنت شركة Eisai المحدودة اليوم أن وحدة تجارب شبكة الزهايمر الموروثة (DIAN-TU) ، بقيادة كلية الطب بجامعة واشنطن في سانت لويس ، قد سجلت المادة الأولى في دراسة المرحلة الثانية / الثالثة (دراسة Tau NexGen). المصدر: https://www.jcnnewswire.com/pressrelease/72519/3/
- 2020
- 2022
- Ad
- تدار
- اتفاقية
- الكل
- اليانز
- من بين
- تحليل
- أعلن
- تطبيق
- المنطقة
- حول
- المتوسط
- خط الأساس
- البداية
- يجري
- الفوائد
- بيتا
- التجارب السريرية
- المعرفية
- للاتعاون
- كلية
- استمر
- حقوق الطبع والنشر
- تصميم
- تصميم
- كشف
- تطوير
- المتقدمة
- التطوير التجاري
- فعل
- اكتشف
- مرض
- الأمراض
- إلى أسفل
- عقار
- المخدرات
- في وقت مبكر
- تأثير
- الأسر
- ادارة الاغذية والعقاقير
- الاسم الأول
- ركز
- طعام
- النموذج المرفق
- وظيفة
- الممولة
- فجوة
- العالمية
- صحة الإنسان
- مرتفع
- HTTPS
- بما فيه
- البنية التحتية
- الابتكار
- عالميا
- IT
- يوليو
- القفل
- ليد
- حقوق الملكية الفكرية
- لندن
- رائد
- مارس
- تجارة
- دواء
- مكبر الصوت : يدعم، مع دعم ميكروفون مدمج لمنع الضوضاء
- المقبلة.
- أكثر
- محليات
- شبكة
- الآباء
- الشراكة
- مجتمع
- مرحلة جديدة
- محوري
- سكان
- عملية المعالجة
- البرنامج
- ويوفر
- تخفيض
- بحث
- النتائج
- مراجعة
- المخاطرة
- السلامة
- المدرسة
- ثانوي
- بذور
- مختار
- SIX
- تباطؤ
- الحلول
- انتشار
- بداية
- الولايه او المحافظه
- إستراتيجي
- دراسات
- دراسة
- اليوم
- سويا
- علاج
- علاج
- محاكمة
- لنا
- جامعة
- واشنطن
- من الذى
- في غضون
- عام
- سنوات