مع العودة المرتقبة إلى الرحلات الفضائية المأهولة طويلة الأمد ، سيواجه رواد الفضاء مخاطر كبيرة من التعرض للإشعاع الفضائي. تشكل الأشعة الكونية المجرية (GCRs) تحديًا خاصًا حيث لا يمكن حمايتها بسهولة ولديها معدلات جرعات تصل إلى 0.5 ملي جرام / يوم.
يعد التشعيع المستمر للجهاز العصبي المركزي مصدر قلق كبير ، سواء بالنسبة لصحة رواد الفضاء على المدى الطويل أو نجاح المهمة بشكل عام. أظهرت الدراسات التي أجريت على القوارض تغيرات سلوكية بعد التعرض لجرعات إشعاعية منخفضة تصل إلى 50 ملي جراي. كما عانى المرضى الذين عولجوا بالعلاج الإشعاعي من ضعف في الإدراك والذاكرة ، وإن كان ذلك بجرعات إشعاعية أعلى بكثير. لكن التقدير الدقيق للمخاطر لرواد الفضاء أمر صعب ، ويرجع ذلك جزئيًا إلى التحديات التقنية لمحاكاة مجال GCR واسع الطيف في المختبر.
في السنوات الأخيرة ، استخدم مختبر ناسا للإشعاع الفضائي جهاز محاكاة GCR جديدًا (جي سي آر إسيم) لتجاربها في علم الأحياء الإشعاعي. يشتمل طيف GCRSim على 33 توليفة من الطاقة الأيونية ويشبه إلى حد بعيد البيئة الإشعاعية التي سيختبرها رواد الفضاء في رحلاتهم إلى القمر والمريخ.
الآن فريق بحث من جامعة هارفارد و مستشفى ماساتشوستس العام أجرى أول تحليل حسابي بمقياس نانومتر لـ GCRSim في هندسة عصبية واقعية. يأمل الفريق أن تكون عمليات المحاكاة المقدمة بتنسيق الفيزياء في الطب وعلم الأحياء، سيساعد الباحثين الذين يجرون تجارب GCRSim على تفسير البيانات البيولوجية.
"كان الدافع وراء هذه الدراسة هو محاكاة ترسب الطاقة المنقولة إلى خلية عصبية في ظل ظروف رحلات فضائية واقعية والتي يمكن أيضًا تكرارها أثناء تجارب البيولوجيا الإشعاعية الأرضية ،" المؤلف الأول جونا بيتر يروي عالم الفيزياء.
نمذجة الخلايا العصبية
يُعتقد أن التغيرات السلوكية التي يسببها الإشعاع تنشأ جزئيًا عن تلف الخلايا العصبية في قرن آمون في الدماغ. على وجه الخصوص ، يمكن أن يتسبب تشعيع الهياكل العصبية الفرعية مثل التشعبات (الامتدادات المتفرعة للخلية العصبية) والعمود الفقري الشجيري (نتوءات صغيرة من التشعبات) في التدهور المعرفي. مع وضع ذلك في الاعتبار ، قام بيتر وزملاؤه بالأداء في silico إعادة بناء الخلايا العصبية التمثيلية للحصين ، بما في ذلك سوما (جسم الخلية) والتشعبات وأكثر من 3500 عمود فقري شجيري.
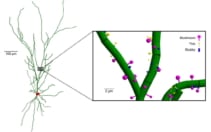
استخدم الفريق محاكاة مونت كارلو لنمذجة مسارات الجسيمات من خلال الخلايا العصبية لكل مجموعة أيون - طاقة GCRSim ، والتي تضمنت 14 طاقة مختلفة من البروتونات وجسيمات ألفا ، بالإضافة إلى خمسة أيونات أثقل.
لجميع عمليات المحاكاة ، تم تحجيم الجرعة الممتصة الإجمالية على الخلية العصبية بأكملها إلى 0.5 Gy ، والجرعة التقريبية التي تعرض لها رائد الفضاء خلال مهمة المريخ لمدة 2-3 سنوات ، والجرعة المستخدمة في تجارب GCRSim.
تنبأ النموذج بجرعات ممتصة إلى سوما والتشعبات والعمود الفقري بعد تشعيع GCRSim 0.54 ± 0.09 ، 0.47 ± 0.02 و 0.8 ± 0.5 غراي ، على التوالي - انحرافًا عن 0.5 غراي بسبب عدم التجانس في ملف التشعيع بطلاقة منخفضة. يوضح بيتر: "يؤدي هذا إلى تقلبات عشوائية في الجرعة الممتصة ، والتي تصبح أكثر وضوحًا في الهياكل الأصغر".
قام الباحثون أيضًا بتحليل ترسب الطاقة لثلاثة أنواع من العمود الفقري المتغصن (عيش الغراب ، أشواك رفيعة وعنيدة). وجدوا أن أشواك الفطر تتلقى حوالي 78 ٪ من إجمالي ترسب طاقة العمود الفقري بسبب حجمها المتوسط الأكبر ، مما قد يعرضها لخطر أكبر للتلف الناجم عن الإشعاع.

ترسب الطاقة
نظرًا للطاقات العالية لجميع الأيونات الأولية في طيف GCRSim ، فإن كل أيون يودع معظم طاقته في الخلايا العصبية عبر الإلكترونات الثانوية. درس الفريق العمليات الفيزيائية المختلفة المرتبطة بترسيب الطاقة هذا ووجد أن المساهمة المهيمنة (59 ٪) جاءت من التأين. هذا مهم ، لأن التأين يسبب أكبر ترسب للطاقة لكل حدث ، مما يجعله ضارًا بشكل خاص.
بالنسبة لجرعة الخلايا العصبية GCRSim 0.5 Gy ، تنبأت المحاكاة بمتوسط 1760 ± 90 حدث ترسيب للطاقة لكل ميكرومتر بطول شجيري ، 250 ± 10 منها تأين. بالإضافة إلى ذلك ، كان هناك ما متوسطه 330 ± 80 و 50 ± 20 و 30 ± 10 أحداث لكل فطر ، عمود فقري رقيق وقصير ، على التوالي ، بما في ذلك 50 ± 10 ، 7 ± 2 و 4 ± 2 تأين لكل عمود فقري.
كشف تقييم التوزيع المكاني لأحداث ترسب الطاقة في جميع أنحاء التشعبات أن التعرض GCRSim يؤدي إلى تشعيع البروتونات لجميع القطاعات التغصنية بجرعات منخفضة جدًا. كان من المحتمل أيضًا أن يكون التعرض للإشعاع على نطاق واسع بواسطة جسيمات ألفا في الجرعات ذات الصلة برحلات الفضاء ، بينما كان التشعيع بواسطة الأيونات الثقيلة نادرًا نسبيًا.
يوضح بيتر قائلاً: "لا يزال هناك الكثير من عدم اليقين الذي يحيط بجوانب إشعاع GCR المسؤولة في النهاية عن التغييرات النهائية في الإدراك أو السلوك". "تشير نتائجنا إلى أن التشعيع الواسع النطاق حتى الهياكل الصغيرة مثل التشعبات العصبية من المحتمل بعد بضعة أشهر فقط من رحلات الفضاء."
إذا كان مثل هذا الإشعاع المتكرر والواسع النطاق هو بالفعل الدافع وراء الخلل الوظيفي في الخلايا العصبية ، فقد يعني ذلك أن مهمات الفضاء السحيق الممتدة أكثر خطورة بشكل غير متناسب من فترات الإقامة القصيرة في مدار أرضي منخفض. يلاحظ بيتر أن هناك حاجة إلى مزيد من البيانات التجريبية قبل استخلاص أي استنتاجات نهائية.

التحدي الكوني: حماية أجهزة الكمبيوتر العملاقة من تهديد خارج الأرض
أخيرًا ، قارن الباحثون نتائجهم بالنتائج التي تم الحصول عليها باستخدام SimGCRSim، طيف مبسط يستخدم أيضًا في تجارب وكالة ناسا. وجدوا أن GCRSim ذات 33 شعاعًا و 6 شعاع SimGCRSim أنتجت أنماطًا متشابهة للغاية وأنماط ترسيب للطاقة على مقياس الخلايا العصبية المفردة.
الهدف النهائي ، كما يقول بيتر ، هو تطوير نموذج ميكانيكي للخلل العصبي الناجم عن الإشعاع. ستكون الخطوة التالية للفريق هي تضمين تأثيرات كيمياء التحلل الإشعاعي في عمليات المحاكاة ، وبعد ذلك ، عند توفر المزيد من البيانات التجريبية ، لاستنتاج الخصائص الفيزيائية والكيميائية المسؤولة عن التغيرات في الوظيفة البيولوجية.