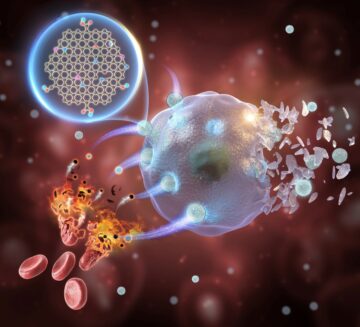
العلاجات التي تستخدم mRNA - مثل بعض لقاحات COVID-19 - لديها إمكانات هائلة للوقاية والعلاج من العديد من الأمراض. تعمل هذه العلاجات عن طريق نقل "تعليمات" الرنا المرسال إلى الخلايا المستهدفة ، وتزويدها بمخطط لصنع بروتينات معينة. يمكن أن تساعد هذه البروتينات الأنسجة على التجدد ، أو استبدال البروتينات غير المؤدية ، أو تحفيز الاستجابة المناعية ، مما يوفر مجموعة متنوعة من استراتيجيات العلاج المختلفة.
ومع ذلك ، فإن العلاج لا يكون مفيدًا إلا إذا تمكن من الوصول إلى هدفه. عادةً ما يتم تعبئة الرنا المرسال داخل جسيم نانوي دهني ، مما يحافظ على سلامة الشحنة الرقيقة حتى تصل إلى وجهتها النهائية. كما هو الحال الآن ، تصل الجسيمات النانوية الدهنية المليئة بالـ mRNA عمومًا إلى عدد قليل من أنواع الخلايا ، مثل الخلايا المناعية والخلايا في الكبد أو الطحال. إن تصميم مثل هذه الجسيمات النانوية الدهنية التي يمكن أن تستهدف الأعضاء التي يصعب الوصول إليها ، مثل القلب أو البنكرياس ، يمكن أن يحدث ثورة في خيارات العلاج لمجموعة واسعة من الحالات.
استجابة لهذه الحاجة ، يقوم الباحثون في جامعة كارنيجي ميلون بتطوير جزيئات نانوية دهنية مصممة لنقل الحمض النووي الريبي (mRNA) إلى البنكرياس على وجه التحديد. يمكن أن تمهد دراستهم على الفئران ، والتي نُشرت مؤخرًا في Science Advances ، الطريق لعلاجات جديدة لأمراض البنكرياس المستعصية ، مثل مرض السكري والسرطان.
أوضحت Luisa Russell ، دكتوراه ، مديرة برنامج في قسم اكتشاف العلوم والتكنولوجيا في المعهد الوطني للتصوير الطبي والهندسة الحيوية (NIBIB). "من خلال تحسين هذه الجزيئات الدهنية والبحث عن طرق بديلة لإيصال الأدوية ، تمكن مؤلفو الدراسة من تصميم جسيمات نانوية دهنية يمكنها توصيل الحمض النووي الريبي بأمان إلى أنسجة البنكرياس في الفئران."
تشمل طرق توصيل أدوية mRNA الحالية الحقن العضلي (المستخدم في لقاحات COVID-19) والإعطاء عن طريق الوريد (المستخدم في بعض علاجات السرطان التجريبية). كخطوة أولى نحو التسليم المستهدف ، أراد مؤلفو الدراسة معرفة ما إذا كان مسار الإدارة المختلفة قد يساعد في توصيل شحنة الرنا المرسال مباشرة إلى البنكرياس. لقد حققوا في توصيل الرنا المرسال عن طريق الحقن داخل الصفاق ، والذي يتضمن حقن الدواء مباشرة في السائل الذي يحيط بأعضاء التجويف البريتوني (بما في ذلك الكلى والأمعاء والبنكرياس).
قالت كبيرة مؤلفة الدراسة كاثرين وايتهيد ، دكتوراه ، أستاذة في جامعة كارنيجي ميلون: "على الرغم من عدم استخدام الحقن داخل الصفاق بشكل شائع عند البشر ، إلا أن هذا النوع من الإعطاء يستخدم سريريًا لبعض الأمراض التي يصعب علاجها ، مثل سرطان المبيض". جامعة. "مع أمراض البنكرياس الخطيرة للغاية ، تفوق فوائد الحقن داخل الصفاق المخاطر."
قام الباحثون بتعبئة تعليمات mRNA الخاصة بـ luciferase اليراع - وهو بروتين مضاء بيولوجي غالبًا ما يستخدم في الأبحاث - في جزيئات نانوية دهنية ، ثم قاموا بحقنها في الفئران إما عن طريق الوريد أو داخل الصفاق. باستخدام لوسيفيراز اليراع المتوهج لمعرفة المكان الذي سافر إليه الرنا المرسال ، وجدوا أن الحقن داخل الصفاق أدى إلى توصيل أكثر وفرة وأكثر تحديدًا للبنكرياس مقارنة بالحقن في الوريد.
بعد ذلك ، بدأ الباحثون في تحسين تكوين جزيئات الدهون التي تتكون منها الجسيمات النانوية. تتمتع الدهون المختلفة بخصائص كيميائية فريدة - مثل الحجم والشحنة الكهربائية والكارهة للماء - يمكن أن تؤثر على ما يحدث للجسيمات النانوية بمجرد دخولها الجسم. يُطلق على أحد أنواع جزيئات الدهون المستخدمة اسم "الدهون المساعدة" ، وقد سميت بهذا الاسم لأنها تساعد على استقرار الجسيمات النانوية وتحسين فعاليتها. أراد الباحثون معرفة ما إذا كان تغيير شحنة الدهن المساعد قد يؤثر على استهداف الجسيمات النانوية ويوجهها نحو البنكرياس. بعد تجربة مجموعة متنوعة من تركيبات الجسيمات النانوية المختلفة ، وجد الباحثون مزيجًا من الدهون التي تعمل على تحسين استهداف البنكرياس في الفئران.
قال مؤلف الدراسة الأول جيليان ميلاميد ، دكتوراه ، باحث ما بعد الدكتوراه في جامعة بنسلفانيا: "خلال العامين الماضيين ، كان هناك تقدير أكبر للكيفية التي يمكن بها للدهون في الجسيمات النانوية إعادة توجيه توصيل الرنا المرسال إلى خلايا وأعضاء مختلفة". . "لا يزال يتم الكشف عن الطرق الدقيقة التي تؤثر بها كيمياء الدهون على فعالية وخصوصية الجسيمات النانوية ، وما زلنا نعمل على فهم كيفية تأثير مكونات الدهون الفردية على توصيل الرنا المرسال بشكل عام."
عندما حقق المؤلفون في المكان الذي كانت تذهب إليه الجسيمات النانوية المُحسَّنة بالضبط في البنكرياس ، فوجئوا باكتشاف أن الرنا المرسال كان أكثر وفرة في خلايا جزيرة البنكرياس ، التي تشكل 1٪ إلى 2٪ فقط من إجمالي أنسجة البنكرياس. خلايا جزيرة البنكرياس مسؤولة عن إنتاج الهرمونات التي تتحكم في الجلوكوز في الدم (مثل الأنسولين). يمكن أن يكون لمثل هذا الاستهداف المحدد تطبيقات سريرية محتملة.
قال وايتهيد: "مع مزيد من التطوير ، قد يؤدي بحثنا إلى إيجاد علاجات لمرض السكري أو أنواع معينة من سرطان البنكرياس". "ومع ذلك ، فإن هذه العلاجات المحتملة تتطلب المزيد من الأبحاث قبل السريرية قبل التقدم إلى التجارب السريرية."
.wordads-ad-wrapper {display: none؛ font: normal 11px Arial، sans-serif؛ letter-spacing: 1px؛ text-decoration: none؛ width: 100٪؛ margin: 25px auto؛ padding: 0؛}. wordads -ad-title {margin-bottom: 5px؛}. wordads-ad-controls {margin-top: 5px؛ text-align: right؛}. wordads-ad-controls span {cursor: pointer؛}. wordads-ad { العرض: محتوى ملائم ؛ الهامش: 0 تلقائي ؛}
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- بلاتوبلوكشين. Web3 Metaverse Intelligence. تضخيم المعرفة. الوصول هنا.
- المصدر https://genesisnanotech.wordpress.com/2023/04/22/lipid-nanoparticles-engineered-to-specifically-target-pancreas-in-mouse-model/
- :يكون
- :ليس
- :أين
- $ UP
- 1
- a
- القدرة
- ماهرون
- إدارة
- السلف
- تؤثر
- بعد
- الكل
- البديل
- an
- و
- التطبيقات
- تقدير
- هي
- AS
- At
- المؤلفة
- الكتاب
- السيارات
- لان
- كان
- قبل
- بدأ
- يجري
- الفوائد
- الطبية الحيوية
- دم
- الجسدي
- by
- تسمى
- CAN
- السرطان.
- حمولة
- كارنيجي ميلون
- جامعة كارنيجي ميلون
- حمل
- خلايا
- معين
- متغير
- تهمة
- مادة كيميائية
- كيمياء
- سريري
- التجارب السريرية
- مجموعة
- عادة
- مقارنة
- مكونات
- الشروط
- مراقبة
- استطاع
- زوجان
- كوفيد-19
- خلق
- نقل
- التوصيل
- تصميم
- تصميم
- تصميم
- افضل الرحلات السياحية
- تطوير
- التطوير التجاري
- مرض السكري
- مختلف
- مباشرة
- مباشرة
- مدير المدارس
- اكتشف
- اكتشاف
- الأمراض
- تقسيم
- عقار
- إما
- ضخم
- يدخل
- أساسيا
- الأثير (ETH)
- بالضبط
- شرح
- دهن
- حقل
- ملفات
- نهائي
- الأول
- مائع
- في حالة
- وجدت
- إضافي
- مزيد من التطوير
- على العموم
- الذهاب
- حفنة
- يحدث
- يملك
- قلب
- مساعدة
- يساعد
- كيفية
- لكن
- HTML
- HTTPS
- البشر
- التصوير
- تحسن
- يحسن
- in
- تتضمن
- بما فيه
- فرد
- تأثير
- معهد
- تعليمات
- إلى
- ينطوي
- IT
- انها
- JPG
- م
- كلاوي
- علم
- قيادة
- كبد
- جعل
- كثير
- هامش
- ماكس العرض
- مايو..
- ميلون
- فأره
- ربما
- نموذج
- جزيء
- الأكثر من ذلك
- أكثر
- مرنا
- عين
- محليات
- حاجة
- عادي
- رواية
- الآن
- of
- ONE
- فقط
- الأمثل
- الأمثل
- تحسين
- مزيد من الخيارات
- or
- لنا
- يفوق
- سرطان المبيض
- الكلي
- الماضي
- ولاية بنسلفانيا
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- رجولية
- محتمل
- حاجة
- الوقاية
- البروفيسور
- البرنامج
- HAS
- بروتين
- البروتينات
- توفير
- نشرت
- نطاق
- الوصول
- يصل
- مؤخرا
- إعادة توجيه
- يحل محل
- التمثيل
- تطلب
- بحث
- الباحث
- الباحثين
- استجابة
- مسؤول
- ثور
- المخاطر
- طريق
- طرق
- بسلام
- قال
- علوم
- كبير
- جدي
- شترستوك
- المقاس
- So
- بعض
- امتداد
- محدد
- على وجه التحديد
- النوعية
- استقرار
- المدرجات
- خطوة
- لا يزال
- استراتيجيات
- دراسة
- هذه
- مندهش
- الهدف
- المستهدفة
- استهداف
- تكنولوجيا
- أن
- •
- من مشاركة
- منهم
- علاجي
- العلاجات
- تشبه
- هم
- عبر
- الأنسجة
- إلى
- الإجمالي
- نحو
- سفر
- سافر
- علاج
- محاكمات
- أنواع
- عادة
- فهم
- فريد من نوعه
- جامعة
- جامعة بنسلفانيا
- تستخدم
- مستعمل
- استخدام
- اللقاحات
- تشكيلة
- بواسطة
- مطلوب
- وكان
- طريق..
- طرق
- we
- كان
- ابحث عن
- التي
- واسع
- مدى واسع
- مع
- WordPress
- للعمل
- عامل
- سوف
- سنوات
- زفيرنت