At bygge proteiner med AI er som at indrette et hus.
Der er to hovedstrategier. Den ene er IKEA-tilgangen: du køber færdiglavede stykker, der nemt kan klikkes sammen, men kan kun håbe, at møblerne passer til dit rum. Selvom det er relativt enkelt, har du ingen kontrol over dimensionerne eller funktionerne af det endelige produkt.
Den anden vej starter med en vision og et design, der er perfekt skræddersyet til dine behov. Men den svære del er at finde - eller bygge - individuelle stykker til det brugerdefinerede design.
De samme to metoder gælder for konstruktion af proteinkomplekser ved hjælp af AI. I lighed med et kabinet er proteinkomplekser lavet af flere underenheder, der binder sammen. Disse megastrukturer – med former lige fra en tyvesidet matrice til tunneler, der åbner og lukker – danner grundlaget for vores stofskifte, immunforsvar og hjernefunktioner.
Tidligere forsøg på at forme proteinarkitekturer brugte for det meste IKEA-tilgangen. Det er revolutionerende: AI-baserede designs har allerede genererede COVID-vacciner med lynets hast. Selvom den er kraftfuld, er tilgangen begrænset af tilgængelige protein-"byggesten".
Denne måned tog et hold ledet af Dr. David Baker fra University of Washington proteindesign til et nyt brugerdefineret niveau. Startende med specifikke dimensioner, former og andre egenskaber benyttede teamet sig af en maskinlæringsalgoritme for at bygge proteinkomplekser skræddersyet til specifikke biologiske reaktioner.
Med andre ord, snarere end den sædvanlige bottom-up-metode, gik de top-down.
Et design er for eksempel en 20-sidet skal, der efterligner det ydre beskyttende lag af vira. Når den var spækket med immunstimulerende proteiner fra influenzavirus, udløste den AI-designede proteinskal et immunrespons hos mus, der overgik de seneste vaccinekandidater i kliniske forsøg.
AI er ikke kun til vacciner. Den samme strategi kunne bygge mere kompakte og effektive bærere til genterapier eller bære antistoffer og andre lægemidler, der har brug for ekstra beskyttelse mod straks at blive nedbrudt i kroppen.
Men mere bredt viser undersøgelsen, at det er muligt at designe massivt komplekse proteinarkitekturer med udgangspunkt i en overordnet vision i stedet for at arbejde med den biologiske ækvivalent af to gange fire boards.
"Det er forbløffende, at holdet kunne gøre dette," sagde Dr. Martin Noble ved Newcastle University, som ikke var involveret i arbejdet. "Det tager evolution milliarder af år at designe enkelte proteiner, der folder helt rigtigt, men dette er et andet niveau af kompleksitet, at folde proteiner for at passe så godt sammen og lave lukkede strukturer."
Evolution med Warp Speed
Kernen i det nye arbejde er forstærkende læring. Du har sikkert hørt om det. Løst baseret på hvordan hjernen lærer gennem trial and error, styrker forstærkningslæring flere AI-agenter, der har taget verden med storm. Den måske bedst kendte er AlphaGo, DeepMind-udsigten, der sejrede over den menneskelige verdensmester i brætspillet Go. For nylig har forstærkende læring været hurtigere fremskridt i selvkørende biler , endda udvikle bedre algoritmer ved at strømline grundlæggende beregninger.
I den nye undersøgelse udnyttede holdet en type forstærkningslæringsalgoritme kaldet Monte Carlo-træsøgningen (MCTS). Selvom det lyder som et kasinotræk, er det en populær strategi for forstærkning, der søger efter optimerede beslutninger.
Forestil dig algoritmen som et træ for dine livsbeslutninger. Vi har sandsynligvis alle undret os over, hvordan vores liv ville være, hvis vi traf et andet valg på et tidspunkt. Hvis du tegner disse alternative beslutninger som en tidslinje – voilà, du har et beslutningstræ, hvor hver kombination af grene fører til et andet resultat.
MCTS er altså lidt ligesom livets spil. Valg vælges ved hver gren tilfældigt og følges ned ad den vej i træet. Når det når det endelige resultat, feeds det op i træet for at øge sandsynligheden for din ønskede løsning. Det er som at udforske multiverset i Alt, overalt, alt på én gang- men i stedet for livsvalg, er det her til at designe proteiner.
Til at starte med fodrede holdet MCTS-algoritmen millioner af proteinfragmenter med specifikke byggemål. Fragmentmængderne blev omhyggeligt vejet: et mindre antal ved hvert beregningstrin fremskynder AI's indlæringsproces og øger diversiteten af det endelige protein. Men flere stykker får også beregningstid og energiforbrug til at skyde i vejret. For at afbalancere dilemmaet byggede holdet adskillige proteinstrukturelementer som udgangspunkt for at begynde proteindesignsøgningen.
Som at fumle med digital Play-Doh, snoede eller bøjede algoritmen derefter proteinfragmenter for at se, om de passerede de overordnede geometriske begrænsninger for det endelige protein - inklusive dets rygrad og dets "fastgørelsespunkter" for at hjælpe fragmenterne med at samle sig selv. Hvis simuleringerne fik tommelfingeren op, blev deres beregningsveje "boostet" i algoritmen. Skyl og gentag titusindvis af gange, og programmet kan finpudse optimale individuelle dele til et bestemt design.
Selvom det lyder som et massivt foretagende, var algoritmen yderst effektiv. Hver iteration tog i gennemsnit kun snesevis af millisekunder, forklarede holdet.
Proteiner på efterspørgsel
I sidste ende havde holdet en kraftfuld algoritme, der - ligesom en arkitekt - designede proteiner baseret på tilpassede behov. I en test lavede AI en række proteinstrukturer fra prismer til pyramider og bogstaver i alfabetet, hvor hver udfyldte et specifikt rum efter behov.
"Vores tilgang er unik, fordi vi bruger forstærkningslæring til at løse problemet med at skabe proteinformer, der passer sammen som brikker af et puslespil. Dette var simpelthen ikke muligt ved at bruge tidligere tilgange og har potentialet til at transformere de typer molekyler, vi kan bygge." sagde undersøgelsesforfatter Isaac Lutz.
Men hvordan oversættes AI-designerne til det virkelige liv?
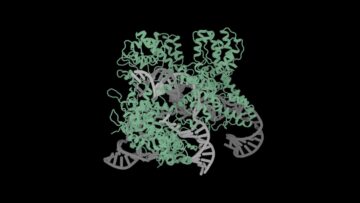
Som et bevis på konceptet lavede holdet hundredvis af proteiner i laboratoriet for at teste for troskab. Ved hjælp af et elektronmikroskop var de AI-designede proteiner næsten identiske med de forudsagte tegninger på atomær skala.
En af de fremtrædende designs var en hul skal lavet med snesevis af proteinstykker. Kaldet en capsid, ligner strukturen det beskyttende proteinlag for vira - et lag, der ofte bruges som en guide til at generere vacciner. I modsætning til tidligere iterationer var de AI-genererede skaller tæt pakket med flere fastgørelsespunkter. Ligesom vægankre kan disse hjælpe strukturerne med at sætte sig fast på celler eller bedre pakkemateriale - lægemidler, genterapier eller andre biologiske materialer - inde i stilladset.
Ved omkring 10 nanometer er disse nano-kapsider "betydeligt mindre end de fleste virale", forklarede holdet.
Den lille størrelse kom med en stor medicinsk punch. I en test satte holdet kapsiderne med 60 kopier af et protein, der hjælper med at stimulere blodkarvækst i menneskelige celler fra navlestrengsvenerne. Den AI-fremstillede proteinboble overgik en tidligere nanopartikel mere end 10 gange. Dette "åbner op for potentielle anvendelser ... for diabetes, hjerneskader, slagtilfælde og andre tilfælde, hvor blodkar er i fare," sagde undersøgelsesforfatter Dr. Hannele Ruohola-Baker.
Et andet eksperiment udnyttede de tætte fastgørelsespunkter på den 20-sidede skal fuldt ud og transformerede capsidet til en effektiv vaccine. Her fusionerede holdet et influenzaprotein HA (influenzahæmagglutinin) til nanokapsiden og injicerede det i mus. Sammenlignet med et lignende, men meget større vaccinedesign, der allerede var i kliniske forsøg, udløste den AI-designede løsning et kraftigere immunrespons.
Indtil videre er AI stadig i de tidlige stadier. Men som de sidste to år har vist, vil det udvikle sig hurtigt. Den 20-sidede skal og andre strukturer "adskiller sig fra alle tidligere designet eller naturligt forekommende strukturer," sagde teamet. Takket være deres lille størrelse, men store bæreevne, kan de potentielt tunnelere inde i cellekernen - som huser DNA - og effektivt shuttle genredigeringskomponenter.
"Dets potentiale til at lave alle slags arkitekturer er endnu ikke fuldt ud undersøgt," sagde undersøgelsesforfatter Dr. Shunzhi Wang.
Billedkredit: Ian Haydon/UW Medicine Institute for Protein Design
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- Platoblokkæde. Web3 Metaverse Intelligence. Viden forstærket. Adgang her.
- Kilde: https://singularityhub.com/2023/04/24/this-ai-can-design-complex-proteins-perfectly-tailored-to-our-needs/
- :har
- :er
- :ikke
- :hvor
- $OP
- 10
- a
- Fordel
- midler
- AI
- algoritme
- Alle
- Alfabet
- allerede
- også
- alternativ
- beløb
- an
- ,
- En anden
- Antistoffer
- enhver
- Indløs
- tilgang
- tilgange
- ER
- AS
- At
- Forsøg på
- forfatter
- til rådighed
- gennemsnit
- tilbage
- Backbone
- baseret
- BE
- fordi
- været
- begynde
- være
- BEDSTE
- Bedre
- Big
- milliarder
- binde
- Bit
- Blocks
- blod
- board
- krop
- Brain
- Branch
- grene
- bredt
- Broken
- boble
- bygge
- Bygning
- bygget
- men
- købe
- by
- kaldet
- CAN
- kandidater
- Kapacitet
- omhyggeligt
- luftfartsselskaber
- bære
- regnskabsmæssige
- tilfælde
- Kasino
- Årsag
- Celler
- vis
- champion
- valg
- valg
- Klinisk
- kliniske forsøg
- lukket
- kombination
- sammenlignet
- komplekse
- kompleksitet
- komponenter
- beregning
- beregninger
- Konceptet
- begrænsninger
- kontrol
- kunne
- Covid
- Oprettelse af
- kredit
- skik
- brugerdefineret design
- David
- beslutning
- beslutning træ
- afgørelser
- DeepMind
- Design
- konstrueret
- designe
- designs
- ønskes
- udvikling
- Diabetes
- Die
- forskellige
- digital
- størrelse
- distinkt
- Mangfoldighed
- do
- Dock
- ned
- snesevis
- Narkotika
- hver
- Tidligt
- nemt
- effektiv
- effektivt
- elementer
- energi
- energiforbrug
- Engineering
- Ækvivalent
- fejl
- evolution
- udvikle sig
- eksempel
- eksperiment
- forklarede
- udforsket
- Udforskning
- ekstra
- Fed
- troskab
- endelige
- passer
- efterfulgt
- Til
- Foundation
- fra
- fuld
- fuldt ud
- funktioner
- fundamental
- spil
- genredigering
- generere
- Go
- Mål
- Vækst
- vejlede
- Hård Ost
- Have
- hørt
- Hjerte
- hjælpe
- hjælper
- link.
- stærkt
- håber
- hus
- huse
- Hvordan
- HTTPS
- menneskelig
- Hundreder
- identisk
- IEEE
- ikea
- straks
- in
- Forøg
- Stigninger
- individuel
- Influenza
- i stedet
- Institut
- ind
- involverede
- IT
- iteration
- iterationer
- ITS
- jpg
- lige
- kendt
- lab
- stor
- større
- seneste
- lag
- førende
- læring
- Led
- Niveau
- Livet
- lyn
- Lynhastighed
- ligesom
- Sandsynlig
- Limited
- Lives
- maskine
- machine learning
- lavet
- Main
- lave
- Martin
- massive
- massivt
- lægemiddel
- medicin
- Mega
- metode
- metoder
- mus
- Mikroskop
- Måned
- mere
- mest
- bevæge sig
- flere
- Multiverse
- Natur
- Behov
- behov
- Ny
- NIH
- Noble
- nu
- nummer
- of
- on
- ONE
- kun
- åbent
- optimal
- optimeret
- or
- Andet
- vores
- Resultat
- i løbet af
- samlet
- pakke
- pakket
- del
- dele
- Bestået
- forbi
- sti
- måske
- stykker
- plato
- Platon Data Intelligence
- PlatoData
- Punkt
- punkter
- Populær
- mulig
- potentiale
- potentielt
- vigtigste
- beføjelser
- forudsagde
- tidligere
- tidligere
- Forud
- sandsynlighed
- sandsynligvis
- Problem
- behandle
- Produkt
- Program
- Progress
- bevis
- Bevis for koncept
- egenskaber
- beskyttelse
- Beskyttende
- Protein
- Proteiner
- slag
- puslespil
- rækkevidde
- spænder
- hurtigt
- hellere
- når
- ægte
- I virkeligheden
- for nylig
- forstærkning læring
- relativt
- gentag
- påkrævet
- Ligner
- svar
- revolutionerende
- Risiko
- groft
- Said
- samme
- Scale
- Videnskab
- Søg
- se
- valgt
- selvkørende
- flere
- former
- forme
- Shell
- vist
- Shows
- lignende
- Simpelt
- ganske enkelt
- enkelt
- Størrelse
- skyrocket
- lille
- mindre
- Snap
- So
- løsninger
- SOLVE
- nogle
- noget
- Space
- specifikke
- hastighed
- hastigheder
- etaper
- starte
- Starter
- starter
- Trin
- Stadig
- Storm
- strategier
- Strategi
- strømlining
- strukturel
- struktur
- Studere
- skræddersyet
- tager
- Tappet
- hold
- prøve
- end
- tak
- at
- verdenen
- deres
- Disse
- de
- denne
- dem
- tusinder
- Gennem
- tid
- gange
- til
- sammen
- Transform
- omdanne
- Oversætte
- træ
- retssag
- forsøg
- typer
- enestående
- universitet
- University of Washington
- brug
- anvendte
- ved brug af
- Vacciner
- vacciner
- Beholder
- virus
- vira
- vision
- Væglampe
- var
- washington
- Vej..
- we
- GODT
- var
- hvornår
- mens
- WHO
- Wikipedia
- med
- ord
- Arbejde
- arbejder
- world
- ville
- år
- dig
- Din
- zephyrnet