Siehe die Zusatzinformationen für weitere Informationen.
GO-Synthese
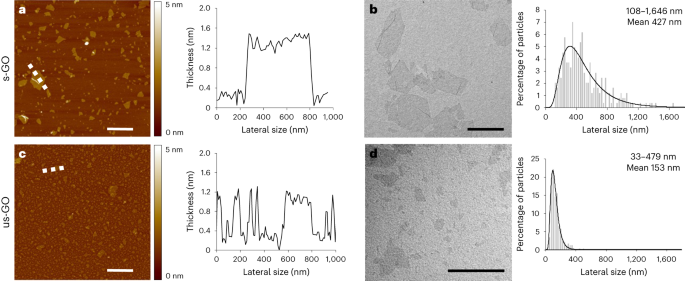
Wässrige Dispersionen von s-GO und us-GO wurden wie in unseren vorherigen Studien beschrieben hergestellt6,45 durch eine modifizierte Hummers-Methode in Verbindung mit Ultraschallbehandlung. Wir verwendeten depyrogenisierte Glaswaren, die unter endotoxinfreien Bedingungen gehandhabt wurden. Graphitpulver wurde mit Natriumnitrat und Schwefelsäure durch kräftiges Rühren bei niedriger Temperatur gemischt, gefolgt von Kaliumpermanganat und tropfenweiser Zugabe von Wasser für Injektionszwecke. Die Mischung wurde 30 Minuten lang bei 98 °C gerührt, bevor die Reaktion mit Wasserstoffperoxid gestoppt wurde. Wasser für Injektionszwecke wurde verwendet, um den pH-Wert zu neutralisieren, Verunreinigungen zu entfernen und das GO von den Graphitrückständen zu trennen. GO wurde durch Vortexen abgeblättert und mit warmem Wasser für Injektionszwecke aus der orangefarbenen Gelschicht gelöst. Eventuell noch in der Dispersion vorhandene Graphitrückstände wurden 24 h nach der Reaktion durch einen zusätzlichen Zentrifugationsschritt entfernt. Die Größenreduzierung auf kleine und ultrakleine Flocken erfolgte durch Ultraschallbehandlung für 5 Minuten bzw. 4 Stunden.
Charakterisierung von GO-Nanoblättern
GO wurde umfassend durch Rasterkraftmikroskopie, Transmissionselektronenmikroskopie, Messungen des hydrodynamischen Durchmessers und der Oberflächenladung (Zetapotential), UV-sichtbare Spektroskopie, Fluoreszenzspektroskopie, Raman-Spektroskopie, Fourier-Transformations-Infrarotspektroskopie, thermogravimetrische Analyse und Röntgenphotoelektronenspektroskopie charakterisiert (siehe). Die Zusatzinformationen für alle Einzelheiten).
Exposition und Charakterisierung von Nanopartikeln
Die Exposition gegenüber Nanopartikeln wurde in einem mobilen Expositionslabor außerhalb des Royal Infirmary of Edinburgh durchgeführt (ergänzende Abbildung). 2), unter Aufsicht eines erfahrenen Belichtungstechnikers. Stammsuspensionen von GO (2 mg ml-1 für s-GO; 1.3 mg ml-1 für US-GO) wurden in sterilem destilliertem Wasser hergestellt, das frei von jeglicher bakterieller Kontamination war, bestätigt durch eine zuvor veröffentlichte Methode10. s-GO wurde auf 1.3 mg/ml verdünnt-1 in steriler Kochsalzlösung unter aseptischen Bedingungen, aliquotiert und bis zur Verwendung bei 4 °C gelagert.
GO wurde in eine 5-ml-Spritze überführt, auf die Spritzenpumpe aufgesetzt und mit einem Schlick-Druckluftzerstäuber (Modell 970/S Untersiemau, Dusen-Schlick) in Aerosolform gebracht, wobei die Lösung mit Wasser in HPLC-Qualität verdünnt wurde. Der komprimierte, vorgewärmte (60 °C) Luftstrom des Schlick-Verneblers betrug 12 lm-1. Das Aerosol wurde in einem beheizten Mischglasrohr getrocknet, dann mit HEPA-gefilterter Raumluft auf die gewünschte Konzentration verdünnt und mit einem Ultraschallvernebler (Omron Ultraschallvernebler NE-U50) auf 60–12 % relative Luftfeuchtigkeit befeuchtet. Das Aerosol wurde in eine 200-l-Mischkammer eingespeist und dem Freiwilligen über eine über Mund und Nase angebrachte Expositionsmaske bei konstanter Temperatur und relativer Luftfeuchtigkeit (50 %) verabreicht. GO wurde in Expositionskonzentrationen zwischen 100 und 300 μg m abgegeben-3, mit einer angestrebten durchschnittlichen Konzentration von 200 μg m-3. Dieser Dosisbereich wurde auf der Grundlage unserer früheren kontrollierten Expositionsstudien mit verdünnten Dieselabgasen ausgewählt, die mit einer Beeinträchtigung einer Reihe von Herz-Kreislauf-Parametern ohne nachteilige Auswirkungen verbunden waren19,30 und mit Kohlenstoff- und Goldnanopartikeln, die die kardiovaskulären Parameter nicht veränderten29,46. Die Konzentration konnte durch Ändern der Geschwindigkeit der Spritzenpumpe, die die Suspension fördert, basierend auf den Messwerten der oszillierenden Mikrowaage mit konischem Element (Modell 1400 A, Thermo Scientific) angepasst und von den Belichtungstechnikern überwacht und aufrechterhalten werden.
Die Partikelkonzentration im Aerosol wurde in der Mitte der 200-l-Mischkammer mit einem Edelstahlrohr gemessen. Die gemessenen Partikeleigenschaften waren: Partikelmasse (oszillierende Mikrowaage mit konischem Element sowie durch gravimetrische Filteranalysen), Partikelanzahl (Kondensationspartikelzähler, Modell 3022 A CPC, TSI Inc.) und Partikelgrößenverteilung (PALAS Differential-Elektromobilitätsklassifikator). (U-DEMC Modell 2200) und einem optischen Partikelgrößenmessgerät (Modell 3330, TSI Inc.)). Die Partikelmasse wurde auch nach der Exposition bestimmt, indem die akkumulierte Masse auf vorab gewogenen Telfonfiltern berechnet wurde, die aus dem Metallrohr in der Nähe der Freiwilligen-Expositionsmaske entnommen wurden.
Ethik-Erklärung
Diese Studie wurde nach strenger ethischer Prüfung konzipiert, wobei die Verfahren von erfahrenen Ärzten und Pflegekräften durchgeführt und in einem großen Krankenhaus mit den erforderlichen Notfalleinrichtungen durchgeführt wurden, falls ein unerwünschtes Ereignis aufgetreten ist. Die Studie wurde in Übereinstimmung mit der Deklaration von Helsinki, der positiven ethischen Stellungnahme der Universität Edinburgh, dem NHS Academic and Clinical Central Office for Research and Development (ACCORD), dem Research Ethics Committee (18-HV-084) und mit schriftlicher Einverständniserklärung durchgeführt von allen Teilnehmern. Die Studie wurde auf Clinicaltrials.gov unter der Referenznummer registriert NCT03659864.
Teilnehmer und Teilnahmekriterien
Fünfzehn gesunde Freiwillige wurden rekrutiert, indem die Studie durch Plakate und E-Mails im Krankenhaus und auf dem Universitätscampus beworben wurde, wie von der örtlichen Ethikprüfung genehmigt. Die Daten von 14 Teilnehmern wurden einbezogen, da ein Teilnehmer nicht in der Lage war, die Expositionsbesuche im Zeitrahmen der Studie abzuschließen. Das Ziel von 15 Personen wurde gemäß unseren früheren kontrollierten Expositionsstudien mit Luftschadstoffen ausgewählt, die auf Veränderungen der Gefäßreaktivität und entzündlichen Zytokinen im Blut aufgrund der Dieselabgasexposition basierten, da es keine anderen kontrollierten Expositionsstudien eines 2D-Materials für Vergleiche gab. Eine einstündige Exposition gegenüber verdünntem Dieselabgas führte zu einer Verringerung des Blutflusses im Unterarm um ca. 1 % auf 32 nmol pro Minute-1 Bradykinin (~16 ± 2 gegenüber ~19 ± 2.5 ml pro 100 ml Gewebe pro Minute (± SD) für Dieselabgase bzw. gefilterte Luftkontrolle19. Eine 2-stündige Exposition gegenüber verdünntem Dieselabgas führte zu einem Anstieg des Plasma-TNF-α um 12.5 % (0.99 ± 0.07 gegenüber 0.88 ± 0.007 pg ml).-1 (±sd) für Dieselabgase im Vergleich zu gefilterter Luft25. Auf der Grundlage dieser Zahlen wären 12 bzw. 10 Freiwillige erforderlich, um diese Veränderungen mit einer Signifikanz von zu erkennen P < 0.05 bei 80 % Leistung. Da in anderen Studien die Auswirkungen eines inhalierten 2D-Materials nicht getestet wurden, wurde als zusätzlicher Vorsichtsschritt beschlossen, die Gruppengröße für diese erste Studie nicht über 15 hinaus zu erhöhen.
Interessierte Teilnehmer erhielten ein Teilnehmerinformationsblatt, das sie mindestens 24 Stunden lang lesen und durchdenken sollten, bevor sie einer Teilnahme an der Studie zustimmten. Bei Studienbesuchen verzichteten die Teilnehmer vor dem Studienbesuch 24 Stunden lang auf Alkohol und verzichteten mindestens 12 Stunden lang auf Nahrungsmittel und koffeinhaltige Getränke. Die Teilnehmer wurden zu einem ersten Screening-Besuch eingeladen, um sicherzustellen, dass sie die Einschlusskriterien erfüllten (Ergänzungstabelle). 2). Um eine offensichtliche Feinstaubbelastung auszuschließen, wurden die Teilnehmer bei ihrem Screening-Besuch nach ihrem Beruf befragt. Wir haben die Teilnehmer nicht gebeten, außerhalb der Studienbesuche eine Gesichtsmaske zu tragen, da eine geringe Compliance eine zusätzliche Quelle für Variabilität zwischen den Teilnehmern geschaffen hätte (die Studie wurde vor der Coronavirus-Pandemie durchgeführt, bevor das Tragen von Masken im Vereinigten Königreich üblich wurde). Es hat sich gezeigt, dass selbst Gesichtsmasken am Arbeitsplatz bei verschiedenen Aktivitätsarten große Unterschiede in der Entfernung eingeatmeter Partikel aufweisen47. Wichtig ist, dass jeder Freiwillige als seine eigene Kontrolle fungierte und jede Exposition in zufälliger Reihenfolge erhielt, wodurch Abweichungen sowohl durch intrinsische Biologie als auch durch Lebensstilfaktoren minimiert wurden.
Studiendesign
Siehe Abb. 2. Ein Screening-Besuch diente dazu, die Zulassungskriterien mit dem Teilnehmer zu bestätigen, gefolgt von der Einholung einer schriftlichen Einwilligung und der Zuweisung eines Teilnehmercodes. Größe, Gewicht, Herzfrequenz, Blutdruck und Lungenfunktion wurden gemessen und eine 3-ml-Blutprobe für eine vollständige Blutzellzählung entnommen. Wenn die Parameter für junge gesunde Personen im normalen Bereich lagen, wurden die Teilnehmer auf volle Studientage vorverlegt. Die Teilnehmer absolvierten außerdem einen abgestuften kardiorespiratorischen Belastungstest auf einem Fahrradergonometer, um die Arbeitsbelastung zu ermitteln, die erforderlich ist, um eine Beatmungsrate von 25 l/min zu erzeugen-1 m-2.
Für die Studie wurden zwei laterale Dimensionen von GO ausgewählt (wobei alle anderen physikalisch-chemischen Eigenschaften nahezu identisch blieben): s-GO und us-GO. Bei beiden Arten von Nanoblättern wurden in unseren früheren präklinischen (Nagetier-)Studien keine akuten oder longitudinalen Nebenwirkungen festgestellt6, im Gegensatz zu „großen“ GO-Platten, die daher aus Sicherheitsgründen von dieser Arbeit ausgeschlossen wurden. Für die Studienbesuche wurde ein doppelblindes, randomisiertes Crossover-Studiendesign verwendet, wobei die Reihenfolge der Expositionen (gefilterte Luft, s-GO, us-GO) randomisiert wurde. Alle Studienbesuche wurden im Abstand von mindestens zwei Wochen organisiert, um eine Auswaschphase zwischen den verschiedenen Expositionen zu ermöglichen. Der Freiwillige und der Kliniker, die die Studie durchführten, waren hinsichtlich der Identität der Expositionsgruppe blind. Alle Forscher, die an der Zusammenstellung und Analyse der Rohdaten beteiligt waren, waren gegenüber der Expositionsgruppe verblindet, wobei die Entblindung erst erfolgte, wenn sie für die Gruppierung nach Exposition bereit waren.
Vor Belichtungen (Zeit t = 0 h) wurden Herzfrequenz, Blutdruck und Lungenfunktion gemessen und Blut abgenommen. Die Teilnehmer wurden gebeten, ihre Blase zu entleeren, und erhielten dann einen Urinbehälter, um den Urin während des Studienbesuchs aufzufangen. Anschließend wurden die Teilnehmer für die Dauer der Studie in das Expositionslabor am Standort Royal Infirmary of Edinburgh gebracht. Ein erfahrener Forschungsmediziner und ein erfahrener Expositionstechniker waren während der gesamten Exposition anwesend, während derselbe Forscher und die gleiche pflegerische Unterstützung während des restlichen Protokolls anwesend waren.
Im Expositionslabor trugen die Teilnehmer eine Gesichtsmaske, durch die Nanopartikel durch Inhalation abgegeben werden konnten. Die Freiwilligen wurden gebeten, mit der erforderlichen Arbeitsbelastung Fahrrad zu fahren, um die Atemfrequenz auf 25 l/min zu erhöhen-1 m-2 (vorbestimmt durch Belastungstests beim Screening-Besuch) und ruhen Sie sich während der 15-stündigen Exposition abwechselnd für 2 Minuten aus. Nach der Exposition kehrte die Versuchsperson zur Beurteilung biologischer Parameter zur klinischen Forschungseinrichtung zurück.
Vitalfunktionen, Lungenfunktion und vor der Exposition entnommenes Blut (t = 0 h), wurden wiederholt t = 2.25, 4 und 6 Stunden (d. h. 15 Minuten, 2 Stunden und 4 Stunden nach der Exposition). Zur besseren Lesbarkeit wird der 2.25-Stunden-Zeitpunkt als bezeichnet t = durchgehend 2 h). Das Ex-vivo-Modell der tiefen arteriellen Verletzung wurde 1–1.5 Stunden nach der Exposition durchgeführt, und die Unterarmplethsymographie wurde 2–4 Stunden nach der Exposition durchgeführt (siehe unten). Es wurde ein leichtes Mittagessen bereitgestellt, das für alle Freiwilligen und alle Studienbesuche identisch war. Als zusätzliche Sicherheitsmaßnahme wurde für die erste Exposition jeder Gruppe ein verkürztes Protokoll (ohne Ex-vivo-Thrombosetest, Unterarmplethysmographie oder 4-Stunden-Messungen) durchgeführt. Die Studienbesuche für die nachfolgenden Freiwilligen mit dem vollständigen Protokoll wurden erst geplant, nachdem bestätigt wurde, dass es keine unerwünschten Ereignisse und keine deutlichen Veränderungen der Blutbiomarker gab. Freiwillige erhielten eine Vergütung für ihre Zeit- und Reisekosten, was von der Ethikkommission genehmigt wurde.
Lungenfunktion und Vitalfunktionen
Die Teilnehmer wurden gebeten, vor der Messung der Vitalfunktionen und der Lungenfunktion 15 Minuten lang sitzend zu ruhen. Die Lungenfunktion wurde mittels Spirometrie (Vitalograph Alpha III) gemessen, wobei beim Screening-Besuch die optimalen Atemtechniken demonstriert wurden. FEV1 Anschließend wurden die Werte für FVC und FVC gemessen und der Mittelwert aus zwei nahezu aufeinanderfolgenden Läufen verwendet. Die Teilnehmer durften weitere 5 Minuten ruhen, bevor der Blutdruck und die Herzfrequenz mittels Blutdruckmessung gemessen wurden.
Gefäßfunktion
Das klinische Protokoll sollte die Messung der Gefäßfunktion als Reaktion auf gefäßerweiternde Medikamente mittels Venenverschlussplethysmographie umfassen19 zwischen t = 4 Std. und t = 6 Std. Aufgrund technischer und personeller Schwierigkeiten war es uns jedoch nicht möglich, verlässliche Daten von genügend Freiwilligen zu erhalten, um aussagekräftige Schlussfolgerungen zu ziehen, weshalb die Daten weggelassen wurden. Weitere Details zur Technik finden Sie im Zusatzinformationen.
Blutbiomarker
Vor der Nanopartikel-Exposition wurde eine Blutprobe entnommen (t = 0 h) und bei 2, 4 und 6 h. Eine 17-Gauge-Kanüle wurde in eine große Ellenbogenvene beider Arme eingeführt und mit steriler Kochsalzlösung gespült. Zunächst wurde 1 ml Blut verworfen und dann etwa 27 ml zur Analyse gesammelt. EDTA-behandeltes Blut wurde für Messungen der Blutzelldifferenzen verwendet, Citrat-behandeltes Blut wurde für Gerinnungsmarker (aktivierte partielle Thromboplastinzeit, Prothrombinzeit, Fibrinogen) verwendet und geronnenes Blut wurde verwendet, um Serum für C-reaktives Protein (CRP) zu sammeln Zytokine (IL-6, TNF-α). Blutmessungen wurden von der Clinical Biochemistry Unit am NHS Royal Infirmary of Edinburgh nach der Standardmethode durchgeführt. Zytokine wurden mithilfe eines Enzymimmunoassays (ELISA) (R&D Systems) mit einer Nachweisgrenze von 0.022 pg ml gemessen-1 für TNF-α und 0.031 pg ml-1 für IL-6. Teilproben von Blut und Urin wurden für das Biobanking bei –80 °C eingefroren.
Ex-vivo-Thrombose
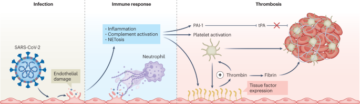
Die Gerinnungsfähigkeit von Blut wurde ex vivo anhand eines Thrombosemodells bei tiefer arterieller Verletzung gemessen (Abb. 6). Wir haben diese Technik ausgiebig in unseren klinischen Studien eingesetzt, nachdem Freiwillige Dieselabgasen ausgesetzt waren30,48 und Prüfung von antithrombotischen Medikamenten49,50. Über ein Pumpenset wurde Blut mit einer Flussrate von 10 ml/min aus einer Ellenbogenvene entnommen-1. Die ersten 5 ml Blut wurden verworfen, bevor die Kanüle über einen nicht koagulierenden Schlauch (Masterflex Tygon, Cole Parmer) mit drei aufeinanderfolgenden zylindrischen Perfusionskammern verbunden wurde, die in einem Wasserbad auf 37 °C gehalten wurden. Durch vorsichtiges Entfernen der Intima und einer dünnen Medienschicht, die als thrombogenes Substrat dienen sollte, wurden Streifen aus der Schweineaorta (Pel-freez) hergestellt und entsprechend der physiologischen Richtung des Blutflusses in der Kammer angebracht. Die rheologischen Bedingungen in der ersten Kammer simulierten die von offenen Koronararterien (geringe Scherrate, ~212 s).-1), während diejenigen in der zweiten und dritten Kammer die von leicht verengten Koronararterien simulieren (hohe Scherrate, ~1,690 s).-1). Das Modell fungiert somit als Modell einer tiefen Koronararterienverletzung. Jeder Kammerdurchlauf dauerte 5 Minuten, danach wurde Kochsalzlösung über den Streifen gespült, um nicht anhaftendes Blut zu entfernen. Die Schweinestreifen mit daran befestigtem Thrombus wurden entfernt und in 4 % Paraformaldehyd fixiert. Die Streifen wurden in acht Querschnitte geschnitten, in Wachs eingebettet, histologisch geschnitten und die endogene Wasserstoffperoxidaktivität mit 3 %iger Wasserstoffperoxidlösung blockiert. Die Schnitte wurden dann 1 Stunde lang bei Raumtemperatur mit polyklonalem Kaninchen-Anti-Human-Fibrin(ogen)-Antikörper (1.2 μg ml) inkubiert-1; Katze. Nr. A0080, Dako) und monoklonaler Maus-Anti-Human-CD61-Antikörper (1.28 μg ml-1; Katze. Nr. M0753, Dako). Die Antigenvisualisierung wurde mit einem Bond Polymer Refine Detection Kit (Leica Microsystems GmbH) und Behandlung mit 3,3′-Diaminobenzidin-Substratchromogen (66 mM, Dako) durchgeführt. Abschließend wurden die Schnitte mit Hämatoxylin und anschließend mit Direktrot 80 (0.1 % Siriusrot) gegengefärbt. Ein halbautomatischer Objektträgerscanner (Axioscan Z1, Zeiss) und eine Bildanalysesoftware (QuPath 0.2.3)51 wurden von einem verblindeten Forscher zur Quantifizierung der Thrombusfläche verwendet. Zur Erkennung der gesamten Thrombusfläche wurden hochauflösende Farbklassifikatoren entwickelt.
Hochpräzise Nanoproteomik-Analyse von Plasmaproben
Herstellung liposomaler Nanopartikel und Anreicherung von Plasmaproteinen
Hyrogeniertes Sojabohnen-Phosphatidylcholin (HSPC): Cholesterin (Chol): 1,2-Distearoyl-sn-glycero-3-phosphoethanolamin-polyethylenglykol2000 (DSPE-PEG2000) wurde durch Hydratisierung eines dünnen Lipidfilms und anschließende Extrusion wie zuvor beschrieben hergestellt52. Lipide wurden in einem Volumenverhältnis von 1:1 Chloroform:Methanol gelöst und unter Vakuum eingedampft. Die Lipidfilme wurden mit Ammoniumsulfat hydratisiert, um große Multilammer-Liposomen zu erzeugen. Kleine unilamellare Liposome wurden durch Extrusion durch Polycarbonat und Extrusionsfilter (Whatman) unter Verwendung eines Mini-Extruders (Avanti Polar Lipids) hergestellt.
Liposomen und menschliches Plasma wurden in einem Orbitalschüttler inkubiert und proteinbeschichtete Liposomen nach einer zuvor beschriebenen Methode von überschüssigen Plasmaproteinen getrennt53 unter Verwendung eines zweistufigen Reinigungsprotokolls, das Größenausschlusschromatographie und Membranultrafiltration umfasste. Gebundene Proteine wurden mit S-Trap-Lysepuffer, der 5 % SDS-Triethylammoniumbicarbonat enthielt, gemischt, um die Solubilisierung des Proteins zu ermöglichen. Die Proben wurden mit Dithiothreitol reduziert und mit Iodacetamid und Dithiothreitol alkyliert. Proteinlysate wurden mit Phosphorsäure und S-Trap-Bindungspuffer gemischt, um Proteine in den Säulen einzufangen, und dann mit Trypsin verdaut. Peptidproben wurden extrahiert und dann mit Oligo-R3-Perlen entsalzt. Die Proben wurden mittels Flüssigchromatographie-Massenspektrometrie/Massenspektrometrie unter Verwendung einer UltiMate 3000 Rapid Separation Lipidchromatographie-Plattform (Dionex Corporation), gekoppelt mit einem Q Exactive Hybrid Quadrupole-Orbitrap-Massenspektrometer (Thermo Fisher Scientific), analysiert. Die Datenanalyse der Peptidproben ist im Folgenden beschrieben Zusatzinformationen.
Eicosanoide und verwandte bioaktive Lipidmediatoren
Eine gezielte Lipidomanalyse wurde unter Verwendung einer Gruppe von >50 Eicosanoiden durchgeführt, zu denen auch Prostaglandine gehörten (PID).2, PGE2PGF2a, 13,14-Dihydro-15-keto-PGD2, 13,14-Dihydro-15-keto-PGE2, 11-Beta-PGF2a, 6-Keto-PGF1a, 15-Desoxy-∆12,14-PGD2, 15-Desoxy-∆12,14-PGJ2); Thromboxane (TxB2, 11-Dehydro-TxB2); Hydroxy-Eicosatetraensäuren (5-HETE, 8-HETE, 9-HETE, 11-HETE, 12-HETE, 15-HETE, 20-HETE); Leukotriene (LTB4, 20-Carboxy-LTB4); Epoxy-Eicosatriensäuren (5,6-EET, 8,9-EET, 11,12-EET, 14,15-EET; 5-OxoETE, 15-OxoETE); Dihydroxy-Eicosatriensäuren (5,6-DHET, 8,9-DHET, 11,12-DHET, 14,15-DHET), Hydroxy-Eicosapentaensäuren (5-HEPE, 15-HEPE), Octadecadiensäuren (9-HODE). ; 13-HODE; 9-Oxo-ODE, 13-Oxo-ODE), Epoxyoctadecamonsäuren (9,10-EpOME, 12,13-EpOME), pro-auflösende Mediatoren (Lipoxin A4 – LXA4 und Resolvine, RvD1, RvD2); Isoprostane (8-iso-PGF2a) und Fettsäuren (Arachidonsäure, Eicosapentaensäure (EPA), Docosahexaensäure (DHA) und ihre Metaboliten, 7-HDHA; 14-HDHA; 17-HDHA; 10,17-DiHDHA).
Plasma wurde aus EDTA-behandeltem Blut hergestellt. Folgende interne Standards wurden verwendet: PGE2-d4, 15-HETE-d8, LTB4-d4, 14,15- EET-d11, 14,15-dHET-d11, 9,10-EpOME-d4, 9,10-DiHOME-d4, RvD2-d5, EPA-d5 und 8-iso-PGF2a-d4 (Cayman Chemical). Siehe die Zusatzinformationen Einzelheiten zur Verarbeitung der Proben finden Sie hier. Eicosanoide wurden auf einer Hypersil GOLD C18-Säule (Thermo) mit einem Shimadzu Nexera-X2 Ultra-Hochleistungs-Flüssigkeitschromatographiesystem getrennt. Der Abfluss wurde in eine IonTurbo-Quelle eines Sciex QTRAP 6500-Massenspektrometers geleitet, das im Negativionenmodus unter Verwendung mehrerer Reaktionsüberwachungen betrieben wurde. Eicosanoide wurden auf der Grundlage ihrer charakteristischen Übergänge von Vorläufer-/Produkt-Ionenpaaren und der Übereinstimmung ihrer Retentionszeit mit authentischen Standards identifiziert. Die Daten wurden mit Sciex Analyst erfasst und analysiert54 Software v1.6. Die Konzentrationen der Eicosanoide wurden durch Vergleich mit einer parallel für jede Verbindung durchgeführten Kalibrierungskurve bestimmt und anhand der Mengen der entsprechenden internen Standards an die Wiederfindung angepasst.
Allgemeine Daten und statistische Analyse
Die Daten wurden mit Excel 2010 analysiert55, R 3.2.2 (ref. 56) und Prism 9.3 (ref. 57). Daten in der Tabelle 1 und erweiterte Datentabellen 1-6 werden als Mittelwert ± Standardabweichung dargestellt, sofern nicht anders angegeben. Kontinuierliche Daten werden als Mittelwert und Standardabweichung dargestellt. Die statistische Signifikanz innerhalb der Gruppen und zwischen Gruppen wurde mithilfe einer bidirektionalen Varianzanalyse mit Tukeys Post-hoc-Test für ehrliche signifikante Unterschiede getestet. Parametrische Annahmen (Normalverteilung und gleiche Varianzen) wurden mithilfe der oben genannten Statistikpakete bestätigt; Wenn die Daten nicht normalverteilt waren, wurde eine nichtparametrische Alternative (z. B. der Kruskal-Wallis-Test) verwendet.
Berichtzusammenfassung
Weitere Informationen zum Forschungsdesign finden Sie im Nature Portfolio-Berichtszusammenfassung mit diesem Artikel verlinkt.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41565-023-01572-3
- :hast
- :Ist
- :nicht
- :Wo
- ][P
- 05
- 07
- 1
- 1.3
- 10
- 100
- 11
- 12
- 13
- 14
- 15%
- 19
- 2%
- 200
- 2005
- 2008
- 2010
- 2011
- 2015
- 2016
- 2017
- 2018
- 2019
- 2020
- 2021
- 24
- 25
- 27
- 28
- 29
- 2D
- 30
- 300
- 3000
- 32
- 34
- 4
- 40
- 45
- 46
- 48
- 49
- 5
- 50
- 51
- 52
- 54
- 55
- 6
- 60
- 66
- 75
- 8
- 80
- 9
- 98
- a
- LiveBuzz
- oben
- akademisch
- accord
- Übereinstimmung
- Nach
- Akkumulieren
- Angesammelt
- erworben
- über
- Handlung
- aktiviert
- Aktivität
- Handlungen
- akuten
- hinzugefügt
- Zusatz
- Zusätzliche
- Bereinigt
- Neben
- Marketings
- Nach der
- gegen
- zustimmen
- LUFT
- Luftverschmutzung
- AL
- Alkohol
- Alle
- erlauben
- erlaubt
- fast
- Aftershave
- ebenfalls
- Alternative
- am
- Beträge
- an
- Analysen
- Analyse
- Analyse
- Analytiker
- Moderator
- und
- Antikörper
- Antigen
- jedem
- auseinander
- angemessen
- genehmigt
- ca.
- SIND
- Bereich
- Waffen
- um
- Artikel
- AS
- fragen
- gefragt
- Bewertung
- Zuordnung
- damit verbundenen
- Annahmen
- At
- angebracht
- Authentic
- verfügbar
- vorwärts
- durchschnittlich
- basierend
- Grundlage
- BE
- wurde
- war
- Bevor
- Beijing
- Sein
- unten
- zwischen
- Getränke
- Beyond
- Bindung
- Biologie
- Biomarker
- Biomarker
- verstopft
- Blut
- Ausgleich bei Blutdruckschwankungen
- Entwurf
- Anleihe
- beide
- gebunden
- Atmen
- puffern
- by
- Koffein
- Berechnung
- Campus
- CAN
- Kohlenstoff
- Herz-Kreislauf-
- österreichische Unternehmen
- vorsichtig
- durchgeführt
- CAT
- Ursachen
- Cayman
- Zelle
- Hauptgeschäftsstelle
- Labor-Klimakammer
- Änderungen
- Merkmal
- Charakteristik
- dadurch gekennzeichnet
- berechnen
- chemisch
- gewählt
- Die Durchblutung
- Klassifikator
- klicken Sie auf
- Klinische
- klinisch
- Ärzten
- Menu
- eng
- Code
- sammeln
- gesammelt
- Kolonne
- Spalten
- kombiniert
- Ausschuss
- gemeinsam
- Vergleich
- Vergleiche
- ausgeglichen
- abschließen
- Compliance
- Compounds
- Computing
- Konzentration
- Schlussfolgerungen
- Bedingungen
- Schichtannahme
- BESTÄTIGT
- Sie
- aufeinanderfolgenden
- Zustimmung
- Geht davon
- konstante
- Container
- kontinuierlich
- Gegenteil
- Smartgeräte App
- gesteuert
- Kernbereich
- Zahnrad
- Coronavirus
- Coronavirus-Pandemie
- KONZERN
- könnte
- zählen
- Counter
- gekoppelt
- Kurs
- Kriterien
- Kurve
- Schneiden
- Zyklus
- Zytokine
- technische Daten
- Datenanalyse
- Tage
- Entscheidung
- Erklärung
- tief
- geliefert
- liefern
- Synergie
- beschrieben
- Design
- entworfen
- erwünscht
- Details
- entdecken
- Entdeckung
- Bestimmen
- entschlossen
- Entwicklung
- DID
- Diesel
- Unterschied
- anders
- Schwierigkeiten
- digital
- Verdünnt
- Größe
- Direkt
- gerichtet
- Richtung
- verworfen
- Entdeckung
- Krankheit
- Dispersion
- verteilt
- Verteilung
- empfohlen
- Drogen
- zwei
- Dauer
- im
- Funktionsstörung
- E & T
- jeder
- erleichtern
- Edinburgh
- Wirksamkeit
- Effekten
- acht
- Element
- Wählbarkeit
- Notfall
- leer
- Motor
- Anreicherung
- gewährleisten
- Arbeitsumfeld
- EPA
- gleich
- etablierten
- Äther (ETH)
- ethisch
- Ethik
- EUR
- Sogar
- Event
- Veranstaltungen
- Beispiel
- Excel
- Überschuss
- ausgeschlossen
- Training
- Kosten
- erfahrensten
- Belichtung
- Ausdruck
- verlängert
- ausführlich
- Gesicht
- Gesichtsmaske
- Gesichtsmasken
- Anlagen
- Einrichtung
- Faktor
- Faktoren
- Fed
- Feige
- Abbildung
- Zahlen
- Filme
- Filme
- Filter
- Filter
- Endlich
- Vorname
- fixiert
- Fluss
- Errötet
- gefolgt
- Folgende
- Nahrung,
- Aussichten für
- Zwingen
- Ausbildung
- gefunden
- Foundation
- Fourier
- FRAME
- Frei
- für
- eingefroren
- voller
- Funktion
- weiter
- erzeugen
- gegeben
- Glas
- GmbH
- Go
- Gold
- bewertet
- Graphene
- sehr
- Gruppe an
- Gruppen
- Richtlinien
- behandelt
- Haben
- gesund
- Herz
- Höhe
- Helsinki
- GUTE
- hochauflösenden
- ehrlich
- Krankenhaus
- aber
- HTTPS
- human
- Humans
- Hybrid
- Hydratation
- Hydrierung
- identisch
- identifiziert
- Identitätsschutz
- if
- iii
- Image
- Bildanalyse
- Beeinträchtigung
- wichtig
- in
- Inc.
- das
- inklusive
- Aufnahme
- Erhöhung
- Steigert
- inkubiert
- angegeben
- Einzelpersonen
- induziert
- entzündlicher
- Information
- informiert
- Anfangs-
- Injektionen
- Verletzung
- intern
- in
- innere
- eingeladen
- beteiligt
- IT
- SEINE
- Reich Gottes
- Ausrüstung
- Labor
- Mangel
- Sprache
- grosse
- Schicht
- am wenigsten
- Lebensstil
- !
- Grenzen
- LINK
- verknüpft
- Flüssigkeit
- aus einer regionalen
- Sneaker
- Mittagessen
- gemacht
- gepflegt
- Aufrechterhaltung
- Dur
- um
- Mann
- markiert
- Maske"
- Masken
- Masse
- Abstimmung
- Ihres Materials
- Materialien
- bedeuten
- sinnvoll
- Mittel
- messen
- gemessen
- Messung
- Messungen
- Medien
- Herren
- versiegelte
- Metall
- Methanol
- Methode
- Methodik
- Mikroskopie
- Microsoft
- Microsoft Excel
- Mitte
- Müller
- Mühlen
- Min.
- minimieren
- gemischt
- Vermischung
- Mischung
- ML
- Mobil
- Mobilität
- Model
- Modell
- Modi
- geändert
- überwacht
- Überwachung
- monoklonal
- Maus
- Mund
- Mukherjee
- mehrere
- nano
- Nanotechnologie
- Natur
- notwendig,
- erforderlich
- NHS
- nicht
- normal
- Normalerweise
- Nase
- Anzahl
- Krankenpflege
- erhalten
- offensichtlich
- Beruf
- beruflich
- aufgetreten
- vorkommend
- of
- Office
- on
- EINEM
- einzige
- XNUMXh geöffnet
- Open-Source-
- betrieben
- Meinung
- optisch
- optimal
- or
- Orange
- Auftrag
- Organisiert
- Andere
- Andernfalls
- UNSERE
- skizzierte
- aussen
- übrig
- besitzen
- Pakete
- Paar
- Pandemie
- Tafel
- Parallel
- Parameter
- Teil-
- Teilnehmer
- Teilnehmer
- Teilchen
- Patent
- Pathologie
- für
- Leistung
- durchgeführt
- Durchführung
- Zeit
- Zeiträume
- platziert
- Plasma
- Plattform
- Plato
- Datenintelligenz von Plato
- PlatoData
- Points
- polar
- Luftverschmutzung
- Polymer
- Mappe
- Position
- positioniert
- Post
- Poster
- Potenzial
- Werkzeuge
- Vorsichtsmaßnahme
- bereit
- Gegenwart
- vorgeführt
- Druck
- verhindern
- früher
- vorher
- Verfahren
- Verarbeitung
- produziert
- Produziert
- Produktion
- Risiken zu minimieren
- Proteine
- Proteine
- Protokoll
- vorausgesetzt
- veröffentlicht
- Pumpe
- R
- F&E
- R3
- Hase
- zufällig
- Zufällig
- Angebot
- schnell
- Bewerten
- Verhältnis
- Roh
- Rohdaten
- Reaktion
- Lesen Sie mehr
- Lesebrillen
- bereit
- Received
- Rezeptor
- Erholung
- Rot
- Reduziert
- Reduktion
- Referenz
- bezeichnet
- verfeinern
- eingetragen
- bezogene
- relativ
- zuverlässig
- Entfernung
- entfernen
- Entfernt
- Entfernen
- wiederholt
- Reporting
- falls angefordert
- Forschungsprojekte
- Forschung und Entwicklung
- Forscher
- Forscher
- Bewohner
- Atem-
- Antwort
- Antworten
- REST
- Beibehaltung
- Überprüfen
- rigoros
- Zimmer
- königlich
- Regel
- Führen Sie
- läuft
- s
- Sicherheit
- gleich
- Sample
- vorgesehen
- SCI
- wissenschaftlich
- regelmäßigen Abständen
- Zweite
- Abschnitt
- Abschnitte
- sehen
- ausgewählt
- getrennte
- Serum
- kompensieren
- Blatt
- Blätter
- verkürzt
- sollte
- gezeigt
- Bedeutung
- signifikant
- Schilder
- simulieren
- am Standort
- Seiten
- Sitzend
- Größe
- Größen
- Schlitten
- klein
- Natrium
- Software
- Lösung
- Quelle
- Quellen
- Spektroskopie
- Geschwindigkeit
- Personaldiensleister
- Edelstahl:
- Standard
- Normen
- statistisch
- Stahl, schwarz
- Schritt
- Immer noch
- Rühren
- -bestands-
- gestoppt
- gelagert
- Der Stress
- Streifen Konfektionierung
- Es wurden Studien
- Studie
- Fach
- Folge
- Substrat
- ausreichend
- Aufsicht
- Support
- Oberfläche
- Suspension
- Suspensions
- Synthese
- System
- Systeme und Techniken
- Tabelle
- gemacht
- Einnahme
- Target
- Team
- Technische
- Techniker
- Technik
- Techniken
- Test
- getestet
- Testen
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- das Vereinigte Königreich
- ihr
- dann
- Dort.
- Diese
- vom Nutzer definierten
- dünn
- Dritte
- fehlen uns die Worte.
- diejenigen
- nach drei
- Durch
- während
- So
- Zeit
- Tissues
- zu
- heute
- nahm
- Gesamt
- übertragen
- Transformieren
- Übergänge
- Übertragung
- Fallen
- reisen
- Behandlungen
- XNUMX
- Typen
- letzte
- Ultra-
- Ultraschall
- nicht fähig
- für
- Einheit
- Vereinigt
- Großbritannien
- Universität
- es sei denn
- bis
- -
- benutzt
- Verwendung von
- v1
- Vakuum
- variieren
- Gegen
- Besuchen Sie
- Besuche
- Visualisierung
- lebenswichtig
- vivo
- Volumen
- Freiwillige
- Freiwillige
- W
- warm
- wurde
- Wasser
- we
- tragen
- Wochen
- Gewicht
- GUT
- waren
- wann
- während
- welche
- Wilson
- mit
- zurückgezogen
- .
- ohne
- Arbeiten
- würde
- geschrieben
- Röntgenstrahl
- jung
- Zephyrnet
- zed