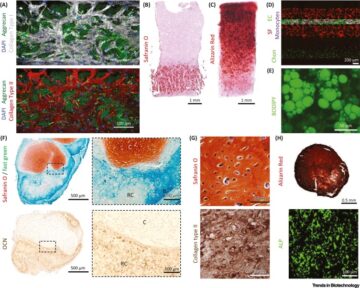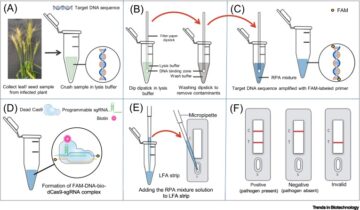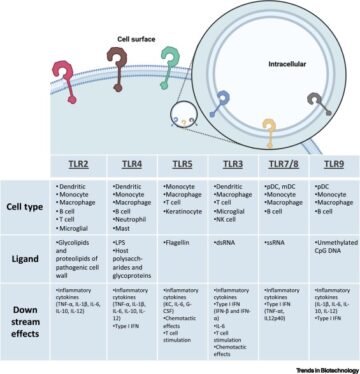
DNA-nanorakenteiden nukleaasiresistenssi.
Nat. Rev. Chem. 2021; 5: 225-239
Kaksi suunnittelustrategiaa monikerroksisen DNA-origami-taiton tehostamiseksi: alakäämitys erityistä interkalaattorin pelastusta varten ja niittien katkaisupaikannus.
Chem. Sei. 2012; 3: 2587-2597
DNA-DNA-nanorakenteiden rakentaminen molekyylilaskentaan, temploituihin kokoonpanoihin ja biologisiin sovelluksiin.
Kertynyt Chem. Res. 2014; 47: 1778-1788
Pyörivän ympyrän vahvistus: monipuolinen työkalu kemialliseen biologiaan, materiaalitieteeseen ja lääketieteeseen.
Chem. Soc. Ilm. 2014; 43: 3324-3341
Isoterminen monistettu DNA:n ja RNA:n havaitseminen.
Mol. BioSyst. 2014; 10: 970-1003
Viimeaikainen edistys DNA-nanorakennepohjaisissa biosensoreissa kasvainmarkkerien havaitsemiseksi.
Biosens. Bioelektroni. 2018; 109: 27-34
Ohjelmoitavien ja monitoimisten DNA-nanokukkien valmistus ja biolääketieteelliset sovellukset.
Nat. Pöytäk. 2015; 10: 1508-1524
Monitoimisten DNA-nanokukkien ei-kanoninen itsekokoonpano biolääketieteellisiin sovelluksiin.
J. Am. Chem. Soc. 2013; 135: 16438-16445
Pyörivän ympyrän monistuspohjaisten DNA-nanorakenteiden rakentaminen biolääketieteellisiin sovelluksiin.
Biomater. Sei. 2022; 10: 3054-3061
Helppokäyttöinen DNA/RNA-nanokukka telomeraasi-RNA:n herkkää kuvaamiseen elävissä soluissa vetoketjun lukitus-ja-avain-strategian pohjalta.
Biosens. Bioelektroni. 2020; 147111788
Kasvaimeen kohdistetut kolesterolilla koristellut DNA-nanokukat solunsisäiseen ratiometriseen aptasensointiin.
Adv. Mater. 2021; 33e2007738
Itse koottuja DNA-nanokukkia, jotka laukaisee DNA-kävelijä erittäin herkkää sähkökemiallista havaitsemista varten. Staphylococcus aureus.
ACS Appl. Mater. Käyttöliittymät 2021; 13: 4905-4914
DNA-kuparihybridianokukat tehokkaina lakkaasin jäljittelijöinä fenoliyhdisteiden kolorimetriseen havaitsemiseen paperin mikrofluidilaitteissa.
Biosens. Bioelektroni. 2021; 182113187
DNA:n funktionaaliset materiaalit, jotka on koottu haarautuneesta DNA:sta: suunnittelu, synteesi ja sovellukset.
Chem. Ilm. 2020; 120: 9420-9481
Mekaaninen metamateriaali, joka on valmistettu DNA-hydrogeelistä.
Nat. Nanotekniikka. 2012; 7: 816-820
Aptameeripohjaiset nanobiosensorit.
Biosens. Bioelektroni. 2016; 76: 2-19
Aptameeri, joka kohdistuu ERBB2-reseptorin tyrosiinikinaasiin kasvainhoidossa.
Menetelmät Mol. Biol. 2015; 1317: 3-15
Aptameeri-modifioitu tetraedrinen DNA-nanorakenne kasvaimeen kohdistettuun lääkkeen antamiseen.
ACS Appl. Mater. Käyttöliittymät 2017; 9: 36695-36701
Biosensointi DNAzymeillä.
Chem. Soc. Ilm. 2021; 50: 8954-8994
DNA-nanorakenteet ohjelmoitavina biomolekyylitelineinä.
Biokonjug. Chem. 2015; 26: 1381-1395
Entsyymien ominaisuuksien manipulointi DNA:n nanorakenteilla.
Molekyylit. 2019; 24: 24
Cas9/sgRNA:n mikroRNA-responsiivinen vapautuminen DNA-nanokukasta sytosolisen proteiinin toimittamiseksi ja genomin parannettua muokkausta varten.
Biomateriaalit. 2020; 256120221
DNA-temploidut kvanttipisteet ja niiden sovellukset biosensoreissa, biokuvauksessa ja terapiassa.
J. Mat. Chem. B. 2020; 8: 9-17
Kvanttipisteiden suora ja tehokas konjugointi DNA-nanorakenteisiin peptidi-PNA:lla.
ACS Nano. 2021; 15: 9101-9110
DNA:n nanoteknologia ja fluoresenssisovellukset.
Curr. Opin. Biotekniikka. 2016; 39: 41-47
Kolmen kasvaimeen liittyvän mRNA:n samanaikainen kuvantaminen elävissä soluissa DNA-tetraedripohjaisella monivärisellä nanokoettimella.
ACS Sens. 2017; 2: 735-739
Luminesoivien ja biofunktionalisoitujen nanokiteiden yksivaiheinen DNA-ohjelmoitu kasvu.
Nat. Nanotekniikka. 2009; 4: 121-125
Biohajoavat, monikäyttöiset DNAzyme-nanokukat tehostettuun syövän hoitoon.
NPG Asia Mater. 2017; 9: e365
Itse koottuja monitoimisia DNA-nanokukkia monilääkeresistenssin kiertämiseen kohdistetussa syöpälääkkeiden toimituksessa.
Nano Res. 2015; 8: 3447-3460
Useiden proteiiniin kapseloitujen DNA-kukkien yhden ruukun synteesi ja niiden käyttö solunsisäisessä proteiinin toimituksessa.
Adv. Mater. 2017; 29https://doi.org/10.1002/adma.201701086
DNA-nanoteknologiaan perustuvat biosensorit ja terapiat.
Adv. Terveysc. Mater. 2021; 10: 20
DNA-nanoteknologiaa hyödyntävä rajapintojen suunnittelu biosensorien kehittämiseen.
Annu. Rev. Anal. Chem. 2018; 11: 171-195
DNA-rungolla suunnitellut sähkökemialliset biosensorit.
Sci. China Life Sci. 2020; 63: 1130-1141
DNAzyme-kulta-nanohiukkaspohjaiset koettimet biosensointiin ja biokuvaukseen.
J. Mat. Chem. B. 2020; 8: 9449-9465
DNA-nanorakenteeseen perustuvat fluoresoivat koettimet solutunnistukseen.
Anaali. menetelmät. 2020; 12: 1415-1429
Aptasensorit pienten molekyylien paikantamiseen.
Biosens. Basel. 2020; 10: 19
Sähköanalyyttinen yleiskatsaus: mikro- ja nanoulotteisten materiaalien hyödyntäminen sähkökemiallisiin biosensointialustoille.
Mikrochim. Acta. 2021; 188: 268
Kehittyneisiin nanomateriaaleihin perustuvat sähkökemialliset anturi- ja biosensorialustat biologisiin ja biolääketieteellisiin sovelluksiin.
Biosens. Bioelektroni. 2018; 103: 113-129
In situ sähkökemiluminoivien DNA-nanokukkien luominen signaalimerkkinä musiini 1:n havaitsemiseen perustuen kohde- ja jäljittelevän kohteen synkronisen syklin monistamisen strategiaan.
Chem. Kommun. 2017; 53: 9624-9627
KemiaValitse. 2022; 7: 8
Nerokas elektrokemiluminesenssibioaptasensori, joka perustuu synergistisiin vaikutuksiin ja entsyymiohjattuihin ohjelmoitaviin 3D DNA-nanokukkiin aflatoksiini B1:n ultraherkkää havaitsemiseen.
Anaali. Chem. 2020; 92: 14122-14129
Synergistinen koreaktantti yksisoluiseen elektrokemiluminesenssikuvaukseen: runsaasti guaniinia sisältävät ssDNA:lla ladatut korkean indeksin fasetoidut kullan nanokukat.
Anaali. Chem. 2021; 93: 7682-7689
Nanomateriaalipohjaisten biosensoreiden suunnittelu elintarviketurvallisuuden havaitsemiseen.
Biosens. Bioelektroni. 2018; 106: 122-128
Ohjelmoitavat DNA-piirit joustavaan ja kestävään eksitoni-plasmoni-vuorovaikutukseen perustuvaan valosähkökemialliseen biosensointiin.
Anaali. Chem. 2021; 93: 11043-11051
Grafeenilla päällystetyt kuparilla seostetut ZnO-kvanttipisteet DNA-nanokukkien laukaiseman trombiinin herkälle fotosähkökemialliseen bioanalyysiin.
J. Mater. Chem. B. 2021; 9: 6818-6824
DNA-kävelijöiden mekanismit, seurantamenetelmät ja sovellukset: katsaus.
ChemPhysChem. 2020; 21: 1971-1988
Biomolekyyleihin konjugoidut metalli-orgaaniset kehykset tehokkaina alustoina biosensorien kehittämiselle.
Trac-Trends Anal. Chem. 2021; 141: 20
Piparjuuriperoksidaasilla kapseloidut DNA-nanokukat: innovatiivinen signaalinmuodostusmerkki kolorimetriseen biosensoriin.
Talanta. 2021; 221121600
Bifunktionaalinen diblock-DNA-välitteinen nanokukan muotoisten fototermisten nanotsyymien synteesi syöpäsolujen erittäin herkkää kolorimetristä määritystä varten.
ACS Appl. Mater. Käyttöliittymät 2021; 13: 16801-16811
Viimeaikaiset edistysaskeleet syövän varhaisessa havaitsemisessa ja diagnosoinnissa: Nukleiinihappopohjaisten aptasensorien rooli.
Trac-Trends Anal. Chem. 2020; 124: 11
POCT-diagnostiikkajärjestelmät, joissa käytetään mikrofluidista lab-on-a-chip -tekniikkaa.
Mikroelektroni. Eng. 2015; 132: 46-57
DNA nanokukka-avusteinen erotusvapaa nukleiinihapon havaitsemisalusta kaupallisella raskaustestiliuskalla.
Angew. Chem. Int. Ed. Eng. 2021; 60: 24823-24827
Loop-mediated isothermal amplification (LAMP): periaate, ominaisuudet ja tulevaisuuden näkymät.
J. Microbiol. 2015; 53: 1-5
Aptameeripohjainen uusi menetelmä eksosomien kompetitiiviseen fluoresenssin havaitsemiseen.
Nanoasteikko. 2019; 11: 15589-15595
DNA-temploidut kuparin nanopartikkelit: monipuolinen alusta leimatuille biomäärityksille.
Trac Trends Anal. Chem. 2018; 105: 436-452
Merkitön biomääritys grafeenioksidipohjaisilla fluoresoivilla aptasensorilla: Katsaus.
Anaali. Chim. Acta. 2021; 1188: 13
Bioinspiroitujen, kokosäädeltyjen, itsestään hajoavien syöpään kohdistettujen DNA-nanokukkien suunnittelu keinotekoisen sandwich-pohjan avulla.
J. Am. Chem. Soc. 2019; 141: 4282-4290
Aptameeriin integroidut DNA-nanorakenteet biosensointiin, biokuvaukseen ja syövän hoitoon.
Chem. Soc. Ilm. 2016; 45: 2583-2602
Monitoimisen DNA-nanopalloviivakoodijärjestelmän synteesi solujen suoraa havaitsemista varten.
Nanoasteikko. 2017; 9: 14094-14102
Fluoresoivien nanomateriaalien ja niihin liittyvien järjestelmien kemia, biologia ja lääketiede: uusia näkemyksiä biosensingistä, biokuvauksesta, genomiikasta, diagnostiikasta ja terapiasta.
Chem. Ilm. 2014; 114: 6130-6178
Viimeaikaiset edistysaskeleet korkean suorituskyvyn fluoresoivissa ja bioluminesoivissa RNA-kuvantamiskoettimissa.
Chem. Soc. Ilm. 2017; 46: 2824-2843
Y-muotoiset DNA-välitteiset hybridinanokukat tehokkaina geenin kantajina kasvaimeen liittyvän mRNA:n fluoresenssikuvaukseen elävissä soluissa.
Anaali. Chim. Acta. 2019; 1057: 114-122
DNA-sekvenssin koodaama pyörivä ympyräamplikoni yksisoluisen RNA-kuvantaan.
Chem. 2018; 4: 1373-1386
Lysosomien paikantamisen mekanismit ja toiminnot.
J. Cell Sci. 2016; 129: 4329-4339
DNA-kukkien solunsisäisen sijainnin ja stabiilisuuden visualisointi leimatulla fluoresoivalla koettimella.
RSC Adv. 2019; 9: 15205-15209
Molekyylisisäisten liikkeiden rajoittaminen: yleinen mekanismi aggregaation aiheuttaman emission takana.
Chem. euroa J. 2014; 20: 15349-15353
FRET biomolekyylisenä tutkimustyökaluna – sen potentiaalin ymmärtäminen välttäen samalla sudenkuopat.
Nat. menetelmät. 2019; 16: 815-829
In situ rolling circle amplification Forster-resonanssienergian siirto (RCA-FRET) pesuvapaaseen reaaliaikaiseen yhden proteiinin kuvantamiseen.
Anaali. Chem. 2021; 93: 1842-1850
Luonnon inspiroimat DNA-kytkimet: sovelluksia lääketieteessä.
nanolääketiede. 2017; 12: 175-179
Aptameerit kohdennettuna terapiana: nykyiset mahdollisuudet ja haasteet.
Nat. Palv. Huumeiden Discov. 2017; 16: 181-202
MikroRNA:n bioswitchable-kuljetus runkonukleiinihapoilla: sovellus luun regeneraatioon.
Pieni. 2021; 17: 12
Metalli-orgaanisten kehysten kaksoisroolit nanokantajina miRNA:n kuljetukseen ja adjuvantteina kemodynaamiseen hoitoon.
ACS Appl. Mater. Käyttöliittymät 2021; 13: 6034-6042
Spatiotemporaalisesti ohjelmoitava hiusneula-DNA:n kaskadihybridisaatio polymeerisessä nanokehyksessä tarkkaan siRNA:n kuljetukseen.
Nat. Commun. 2021; 12: 12
Viimeaikaiset suuntaukset syöpähoidossa: katsaus geenien toimituksen nykytilaan.
Life Sci. 2021; 269: 15
siRNA-kuljetusjärjestelmät syövän hoitoon.
Adv. Huumeiden toimitus. Rev. 2009; 61: 850-862
Biohajoavat polymeerit geenien vaimentamisessa.
Polym. Adv. Technol. 2019; 30: 2647-2655
Ohjelmoitavat DNA-nanokukat biosensointiin, biokuvaukseen ja hoitoon.
Kemia. 2020; 26: 14512-14524
Itse kootut peptidi- ja proteiininanorakenteet syövän vastaiseen hoitoon: kohdennettu annostelu, ärsykkeisiin reagoivat laitteet ja immunoterapia.
Nano tänään. 2021; 38: 29
DNA-nanoteknologian mahdollistavat lääkkeenantojärjestelmät.
Chem. Ilm. 2019; 119: 6459-6506
Signaaliprosessori, joka on valmistettu DNA-kokoonpanosta ja ylöskonversionanohiukkasista farmakokineettistä tutkimusta varten.
Nano tänään. 2022; 42: 11
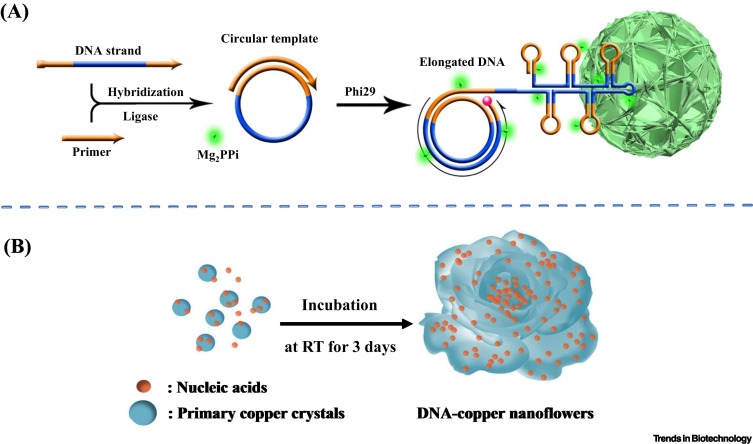
Pyörivän ympyrän replikointi biosensingissä, biokuvauksessa ja biolääketieteessä.
Trends Biotechnol. 2021; 39: 1160-1172
Pyöreät nukleiinihapot: löytö, toiminnot ja sovellukset.
ChemBioChem. 2020; 21: 1547-1566
Bioinspiroitu DNA-epäorgaanisten hybridikomposiittien valmistus synteettistä DNA:ta käyttäen.
ACS Nano. 2019; 13: 2888-2900
Mangaani-, koboltti- ja sinkki-DNA-nanokukkien valmistus ja karakterisointi viritettävällä morfologialla, DNA-sisällöllä ja -koolla.
Nucleic Acids Res. 2018; 46: 7495-7505
Proteiini-epäorgaaniset hybridi nanokukat.
Nat. Nanotekniikka. 2012; 7: 428-432
Yksinkertainen ja ympäristöystävällinen nukleaasiresistenttien DNA-epäorgaanisten hybridien nanokukkien synteesi yhdessä ruukussa.
J. Mater. Chem. B. 2017; 5: 2231-2234
Orgaaniset ja epäorgaaniset hybridinanokukat: tyypit, ominaisuudet ja tulevaisuuden näkymät.
J. Nanobiotechnol. 2015; 13: 10
Biomimeettinen kuparipohjainen epäorgaaninen proteiini nanokukkakokoonpano, joka on rakennettu nanomittakaavan kuitukalvolle, jolla on parannettu vakaus ja kestävyys.
J. Phys. Chem. C. 2016; 120: 17348-17356
Bioinspiroidut DNA-epäorgaaniset hybridinanokukat yhdistettynä henkilökohtaiseen glukoosimittariin miRNA:n havaitsemiseen paikan päällä.
ACS Appl. Mater. Käyttöliittymät 2018; 10: 42050-42057
DNA-nanomateriaalien biologiset sovellukset: nykyiset haasteet ja tulevaisuuden suunnat.
Signaalin siirto. Kohde. Siellä. 2021; 6: 28
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- Platoblockchain. Web3 Metaverse Intelligence. Tietoa laajennettu. Pääsy tästä.
- Lähde: https://www.cell.com/trends/biotechnology/fulltext/S0167-7799(22)00229-3?rss=yes
- 1
- 3d
- a
- kehittynyt
- ennakot
- ja
- Hakemus
- sovellukset
- keinotekoinen
- Aasia
- koolla
- Kokoonpano
- Tekijät
- välttämällä
- pohja
- perustua
- takana
- biologia
- biolääketieteen
- LUU
- Syöpä
- Syöpäsolut
- syövän hoitoon
- harjoittajat
- vesiputouksia
- Solut
- haasteet
- ominaisuudet
- kemiallinen
- Kiina
- Ympyrä
- yhdistetty
- kaupallinen
- kilpailukykyinen
- laskeminen
- pitoisuus
- Kupari
- Nykyinen
- Nykyinen tila
- toimitus
- Malli
- Detection
- Kehitys
- Laitteet
- ohjata
- löytö
- dna
- huume
- kestävyys
- Varhainen
- ed
- vaikutukset
- tehokas
- päästö
- energia
- Tekniikka
- tehostettu
- EUR
- Ominaisuudet
- joustava
- ruoka
- Puitteet
- puitteet
- alkaen
- toiminnallinen
- tehtävät
- tulevaisuutta
- general
- sukupolvi
- genomin
- genomiikka
- Kulta
- Grafeeni
- Kasvu
- korkea suorituskyky
- erittäin
- HTTPS
- Hybridi
- Imaging
- in
- innovatiivinen
- oivalluksia
- rajapinnat
- elämä
- Lista
- elävät
- sijainti
- tehty
- tarvikkeet
- mekaaninen
- mekanismi
- lääketiede
- menetelmä
- menetelmät
- MOL
- molekyyli-
- mRNA
- moninkertainen
- nano
- nanomateriaalien
- nanoteknologian
- Uusi
- seuraavan sukupolven
- romaani
- yleiskatsaus
- Paperi
- henkilöstö
- foorumi
- Platforms
- Platon
- Platonin tietotieto
- PlatonData
- polymeerit
- paikannus
- mahdollinen
- Raskaus
- periaate
- anturi
- Suoritin
- ominaisuudet
- tulevaisuudennäkymät
- Proteiini
- Kvantti
- Kvanttipisteet
- reaaliaikainen
- liittyvä
- vapauta
- replikointi
- pelastus
- tutkimus
- vastus
- resonanssi
- arviot
- RNA
- luja
- Rooli
- roolit
- Rolling
- Turvallisuus
- SCI
- tiede
- sensible
- signaali
- Yksinkertainen
- Koko
- pieni
- erityinen
- Pysyvyys
- Osavaltio
- strategiat
- Strategia
- Kuori
- tutkimus
- synteettinen
- järjestelmä
- järjestelmät
- TAG
- Kohde
- kohdennettu
- kohdistaminen
- Technologies
- Elektroniikka
- testi
- Testaus
- -
- heidän
- terapeutiikka
- hoito
- kolmella
- että
- tänään
- työkalu
- kohti
- Seuranta
- siirtää
- hoito
- Trendit
- laukeaa
- tyypit
- monipuolinen
- kautta
- W
- Walkers
- vaikka
- X
- zephyrnet