Cambridge, MA, 28 janvier 2022 - (JCN Newswire) - Biogen Inc. et Eisai Co., Ltd. (Tokyo, Japon) ont annoncé aujourd'hui des détails supplémentaires sur l'étude de confirmation post-commercialisation de phase 4, ENVISION, d'ADUHELM (aducanumab- avwa) Injection de 100 mg/mL pour une utilisation intraveineuse au stade précoce de la maladie d'Alzheimer, y compris les détails de l'objectif de l'étude pour une inscription diversifiée et le critère d'évaluation principal.
Biogen vise à inscrire 18 % des participants américains à ENVISION parmi les populations noires/afro-américaines et latines. Cet objectif reflète l'engagement continu de Biogen à accroître la diversité des essais cliniques.
« Historiquement, les patients d'horizons divers ont été mal représentés dans les essais cliniques sur la maladie d'Alzheimer, et nous nous engageons à changer cela », a déclaré Priya Singhal MD, MPH, responsable des sciences mondiales de la sécurité et de la réglementation et responsable par intérim de la recherche et du développement chez Biogen. "Cet objectif correspond à la diversité parmi les Américains diagnostiqués avec la maladie d'Alzheimer précoce, tandis que dans le même temps, l'essai générera des données substantielles pour vérifier l'efficacité d'ADUHELM."
Biogen mettra en œuvre plusieurs stratégies pour aider à surmonter les obstacles à l'inscription de divers patients dans les essais sur la maladie d'Alzheimer, tels que le manque d'accès aux centres médicaux, la familiarité avec le profil avantages/risques du traitement et les charges financières ou logistiques.
« Il est important de voir cet accent ambitieux sur la diversité être priorisé dans le recrutement et intégré comme un élément clé de l'essai clinique ENVISION, afin que nous puissions avoir des données de patients qui représentent plus étroitement ce que nous voyons dans la clinique », a déclaré Dylan Wint, MD, Cleveland Clinic Lou Ruvo Center for Brain Health, Nevada.
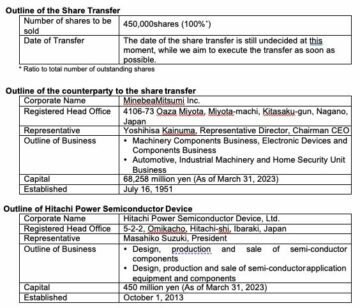
Les sociétés ont également annoncé aujourd'hui que le critère d'évaluation principal de l'essai ENVISION mondial contrôlé par placebo sera mesuré par la somme des cases d'évaluation de la démence clinique (CDR-SB) 18 mois après le début du traitement avec ADUHELM. Le critère d'évaluation CDR-SB est une mesure validée de la cognition et de la fonction qui est largement utilisée dans les essais cliniques de patients atteints de la maladie d'Alzheimer symptomatique précoce, est compatible avec les études de phase 3 EMERGE et ENGAGE d'ADUHELM et capable de générer des résultats solides. La mise à jour comprend également une augmentation de l'inscription précédemment annoncée, de 1,300 1,500 à XNUMX XNUMX personnes atteintes de la maladie d'Alzheimer précoce (troubles cognitifs légers dus à la maladie d'Alzheimer et maladie d'Alzheimer légère), avec confirmation de la pathologie bêta-amyloïde, pour renforcer encore les données fournies par le étude.
Bien qu'ENVISION et d'autres essais cliniques ADUHELM soient déjà prévus ou en cours, les Centers for Medicare and Medicaid Services (CMS) ont récemment publié un projet de détermination de la couverture nationale (NCD), qui limiterait la couverture Medicare d'ADUHELM et d'autres thérapies ciblant l'amyloïde aux patients inscrits dans des essais cliniques supplémentaires. Biogen s'est engagé à collaborer avec CMS pour éviter la duplication inutile des essais cliniques et s'efforce de trouver une voie pour offrir un accès immédiat aux patients au premier traitement approuvé par la FDA pour la maladie d'Alzheimer depuis 2003.
En plus du critère d'évaluation principal, le CDR-SB, les critères d'évaluation secondaires comprennent l'échelle d'évaluation de la maladie d'Alzheimer - la sous-échelle cognitive (ADAS-Cog 13), l'étude coopérative sur la maladie d'Alzheimer - l'inventaire des activités de la vie quotidienne - la version sur les troubles cognitifs légers (ADCS-ADL-MCI) , l'échelle d'évaluation intégrée de la maladie d'Alzheimer (iADRS), le mini-examen de l'état mental (MMSE) et l'inventaire neuropsychiatrique (NPI-10).
Le début du dépistage des patients pour ENVISION est prévu pour mai 2022. Sur la base des taux de recrutement des précédents essais de phase 3 avec ADUHELM, la date d'achèvement principale devrait être d'environ quatre ans après le début de l'étude. Les entreprises sont reconnaissantes aux professionnels de la santé, aux centres médicaux, aux patients et aux familles qui participeront à cet essai.
Auparavant, en juillet 2021(Nouvelle fenêtre), les sociétés avaient fixé un autre objectif de diversité substantiel dans l'essai observationnel de phase 4 ICARE AD, qui vise à recruter un total d'environ 6,000 XNUMX patients.
À propos d'ADUHELM (aducanumab-avwa) injectable à 100 mg/mL pour usage intraveineux
ADUHELM est indiqué dans le traitement de la maladie d'Alzheimer. Le traitement par ADUHELM doit être initié chez les patients présentant une déficience cognitive légère ou un stade de démence légère de la maladie, la population dans laquelle le traitement a été initié dans les essais cliniques. Il n'existe pas de données d'innocuité ou d'efficacité sur l'instauration d'un traitement à des stades plus précoces ou plus avancés de la maladie que ceux étudiés. Cette indication est approuvée dans le cadre d'une approbation accélérée basée sur la réduction des plaques bêta-amyloïdes observée chez les patients traités par ADUHELM. Le maintien de l'approbation pour cette indication peut dépendre de la vérification du bénéfice clinique dans le(s) essai(s) de confirmation.
ADUHELM est un anticorps monoclonal dirigé contre la bêta amyloïde. L'accumulation de plaques bêta-amyloïdes dans le cerveau est une caractéristique physiopathologique déterminante de la maladie d'Alzheimer. L'approbation accélérée d'ADUHELM a été accordée sur la base des données d'essais cliniques montrant l'effet d'ADUHELM sur la réduction des plaques bêta-amyloïdes, un biomarqueur de substitution qui est raisonnablement susceptible de prédire un bénéfice clinique, en l'occurrence une réduction du déclin clinique.
ADUHELM peut provoquer des effets secondaires graves, notamment : les anomalies d'imagerie liées à l'amyloïde ou "ARIA". ARIA est un effet indésirable courant qui ne provoque généralement aucun symptôme mais qui peut être grave. Bien que la plupart des gens ne présentent pas de symptômes, certaines personnes peuvent présenter des symptômes tels que : maux de tête, confusion, étourdissements, troubles de la vision et nausées. Le fournisseur de soins de santé du patient effectuera des examens d'imagerie par résonance magnétique (IRM) avant et pendant le traitement par ADUHELM pour vérifier la présence d'ARIA. ADUHELM peut également provoquer des réactions allergiques graves. Les effets secondaires les plus fréquents d'ADUHELM comprennent : un gonflement dans certaines zones du cerveau, avec ou sans petites taches de saignement dans le cerveau ou à la surface du cerveau (ARIA) ; mal de tête; et tomber. Les patients doivent appeler leur fournisseur de soins de santé pour obtenir des conseils médicaux sur les effets secondaires.
Depuis octobre 2017, Biogen et Eisai Co., Ltd. collaborent au co-développement mondial et à la co-promotion de l'aducanumab.
À propos de Biogen
En tant que pionniers des neurosciences, Biogen découvre, développe et propose des thérapies innovantes dans le monde entier pour les personnes vivant avec des maladies neurologiques graves ainsi que des contiguïtés thérapeutiques connexes. L'une des premières sociétés mondiales de biotechnologie au monde, Biogen a été fondée en 1978 par Charles Weissmann, Heinz Schaller, Sir Kenneth Murray et les lauréats du prix Nobel Walter Gilbert et Phillip Sharp. Aujourd'hui, Biogen possède un portefeuille de médicaments de premier plan pour traiter la sclérose en plaques, a introduit le premier traitement approuvé pour l'amyotrophie spinale et fournit le premier et le seul traitement approuvé pour traiter une pathologie déterminante de la maladie d'Alzheimer. Biogen commercialise également des biosimilaires et se concentre sur l'avancement du pipeline le plus diversifié de l'industrie en neurosciences qui transformera la norme de soins pour les patients dans plusieurs domaines où les besoins non satisfaits sont élevés.
En 2020, Biogen a lancé une initiative audacieuse de 20 millions de dollars sur 250 ans pour résoudre les problèmes profondément interdépendants du climat, de la santé et de l'équité. Healthy Climate, Healthy Lives vise à éliminer les combustibles fossiles dans toutes les activités de l'entreprise, à établir des collaborations avec des institutions renommées pour faire progresser la science afin d'améliorer les résultats pour la santé humaine et à soutenir les communautés mal desservies.
À propos d'Eisai Co., Ltd.
Eisai Co., Ltd. est une société pharmaceutique mondiale de premier plan dont le siège est au Japon. La philosophie d'entreprise d'Eisai est basée sur le concept de soins de santé humains (hhc), qui consiste à penser d'abord aux patients et à leurs familles, et à augmenter les avantages que les soins de santé leur procurent. Avec un réseau mondial d'installations de R&D, de sites de fabrication et de filiales de commercialisation, nous nous efforçons de concrétiser notre philosophie hhc en proposant des produits innovants pour cibler les maladies avec des besoins médicaux non satisfaits élevés, avec un accent particulier sur nos domaines stratégiques de la neurologie et de l'oncologie.
Tirant parti de l'expérience acquise dans le développement et la commercialisation d'un traitement pour la maladie d'Alzheimer, Eisai vise à établir la « plateforme de démence Eisai ». Grâce à cette plate-forme, Eisai prévoit d'offrir de nouveaux avantages aux personnes atteintes de démence et à leurs familles en construisant un « écosystème de la démence », en collaborant avec des partenaires tels que des organisations médicales, des sociétés de développement de diagnostics, des organismes de recherche et des bio-entreprises en plus d'entreprises privées. agences d'assurance, industries financières, clubs de fitness, constructeurs automobiles, détaillants et établissements de soins. Pour plus d'informations sur Eisai Co., Ltd., veuillez visiter https://www.eisai.com.
PERSONNES-RESSOURCES
Biogène inc.
Ashleigh Koss
+ 1-908-205-2572
public.affairs@biogen.com
Eisai Inc. (médias américains)
Département des relations publiques
+1-201-753-1945
Eisai Co., Ltd. (médias en dehors des États-Unis)
Département des relations publiques
TEL: +81-(0)3-3817-5120
Safe Harbor de Biogen
Ce communiqué de presse contient des déclarations prospectives, y compris des déclarations faites conformément aux dispositions d'exonération de la loi Private Securities Litigation Reform Act de 1995, concernant les effets cliniques potentiels d'ADUHELM ; les bénéfices potentiels, l'innocuité et l'efficacité d'ADUHELM ; résultats d'ENVISION ; le traitement de la maladie d'Alzheimer ; les avantages et le potentiel prévus des accords de collaboration de Biogen avec Eisai ; programmes de développement clinique, essais cliniques et lectures et présentations de données ; et les risques et incertitudes associés au développement et à la commercialisation des médicaments. Ces déclarations peuvent être identifiées par des mots tels que "viser", "anticiper", "croire", "pourrait", "estimer", "s'attendre à", "prévoir", "avoir l'intention de", "peut", "planifier", " possible », « potentiel », « sera », « serait » et d'autres mots et termes de sens similaire. Le développement et la commercialisation de médicaments comportent un degré de risque élevé, et seul un petit nombre de programmes de recherche et de développement aboutissent à la commercialisation d'un produit. Les résultats des essais cliniques à un stade précoce peuvent ne pas être indicatifs des résultats complets ou des résultats d'essais cliniques à un stade ultérieur ou à plus grande échelle et ne garantissent pas l'approbation réglementaire. Vous ne devez pas vous fier indûment à ces déclarations ou aux données scientifiques présentées.
Ces déclarations impliquent des risques et des incertitudes qui pourraient faire en sorte que les résultats réels diffèrent sensiblement de ceux reflétés dans ces déclarations, y compris, sans s'y limiter, des préoccupations inattendues pouvant découler de données, d'analyses ou de résultats supplémentaires obtenus au cours d'essais cliniques ; la survenance d'événements indésirables pour la sécurité ; les risques de coûts ou de retards imprévus ; le risque d'autres obstacles inattendus ; l'incapacité à protéger et à faire respecter les données, la propriété intellectuelle et les autres droits de propriété de Biogen et les incertitudes liées aux réclamations et contestations de propriété intellectuelle ; les risques associés aux réformes actuelles et futures potentielles des soins de santé ; réclamations en responsabilité du fait des produits ; les risques de collaboration avec des tiers ; et les impacts directs et indirects de la pandémie de COVID-19 en cours sur les activités, les résultats d'exploitation et la situation financière de Biogen. Ce qui précède énonce de nombreux facteurs, mais pas tous, qui pourraient faire en sorte que les résultats réels diffèrent des attentes de Biogen dans toute déclaration prospective. Les investisseurs doivent tenir compte de cette mise en garde ainsi que des facteurs de risque identifiés dans le rapport annuel ou trimestriel le plus récent de Biogen et dans d'autres rapports que Biogen a déposés auprès de la Securities and Exchange Commission des États-Unis. Ces déclarations sont basées sur les croyances et les attentes actuelles de Biogen et ne sont valables qu'à la date de ce communiqué de presse. Biogen n'assume aucune obligation de mettre à jour publiquement les déclarations prospectives, que ce soit à la suite de nouvelles informations, de développements futurs ou autrement.
Copyright 2022 JCN Newswire. Tous les droits sont réservés. www.jcnnewswire.comBiogen Inc. et Eisai Co., Ltd. (Tokyo, Japon) ont annoncé aujourd'hui des détails supplémentaires sur l'étude de confirmation post-commercialisation de phase 4, ENVISION, d'ADUHELM (aducanumab-avwa) 100 mg/mL injectable pour usage intraveineux au stade précoce de la maladie d'Alzheimer, y compris les détails de l'objectif de l'étude pour une inscription diversifiée et le critère d'évaluation principal. Source : https://www.jcnnewswire.com/pressrelease/72730/3/
- &
- 000
- 100
- 2020
- 2022
- Description
- accès
- à travers
- Agis
- activités
- Ad
- Supplémentaire
- propos
- conseils
- Tous
- déjà
- Bien que
- Américaine
- Américains
- parmi
- selon une analyse de l’Université de Princeton
- annoncé
- annuel
- obstacles
- va
- qui ne s'occupent pas de leur chez-soi.
- bêta
- biotechnologie
- construire
- la performance des entreprises
- Appelez-nous
- les soins
- Causes
- globaux
- Charles
- prétentions
- essais cliniques
- cognitif
- collaboration
- commission
- engagement
- Commun
- Communautés
- Sociétés
- Société
- condition
- confusion
- contient
- coopérative
- droit d'auteur
- Costs
- pourriez
- COVID-19
- Pandémie de COVID-19
- Courant
- données
- retards
- livrer
- Développement
- développements
- différer
- Maladie
- maladies
- Diversité
- drogue
- "Early Bird"
- stade précoce
- risque numérique
- effet
- Endpoint
- équité
- estimation
- événements
- échange
- attendu
- Découvrez
- facteurs
- Échec
- familles
- fda
- Fonctionnalité
- finance
- la traduction de documents financiers
- Prénom
- de l'aptitude
- Focus
- tourné vers l'avenir
- plein
- fonction
- avenir
- générer
- Global
- réseau mondial
- objectif
- front
- Santé
- Soins de santé
- la médecine
- aider
- Haute
- HTTPS
- Haies
- Mettre en oeuvre
- important
- Inc
- Y compris
- Améliore
- secteurs
- d'information
- initiative
- les établissements privés
- Assurance
- des services
- intellectuel
- propriété intellectuelle
- inventaire
- Investisseurs
- vous aider à faire face aux problèmes qui vous perturbent
- Japon
- Juillet
- clés / KEY :
- plus importantes
- conduisant
- responsabilité
- Contentieux
- fabrication
- Stratégie
- mesurer
- Médias
- médical
- Medicare
- million
- mois
- (en fait, presque toutes)
- Nationales
- réseau et
- nouvelles
- code
- Opérations
- organisations
- Autre
- autrement
- pandémie
- participants
- participer
- partenaires,
- Personnes
- Pharmaceutique
- phase
- philosophie
- plateforme
- population
- portefeuille
- Présentations
- Privé
- Produit
- Produits
- ,une équipe de professionnels qualifiés
- Profil
- Programmes
- propriété
- protéger
- fournit
- public
- R & D
- Tarifs
- réactions
- régulateurs
- dépendance
- Célèbre
- rapport
- Rapports
- un article
- Recherche et développement
- Résultats
- les détaillants
- Analyse
- facteurs de risque
- des
- Sécurité
- Saïd
- Escaliers intérieurs
- Sciences
- STARFLEET SCIENCES
- secondaire
- titres
- Securities and Exchange Commission
- Services
- set
- similaires
- Sites
- petit
- So
- Étape
- Région
- Déclaration
- Stratégique
- les stratégies
- et le cannabis
- Étude
- Ces
- Support
- Surface
- Target
- Avec
- fiable
- aujourd'hui
- tokyo
- Transformer
- traiter
- traitement
- procès
- nous
- Securities and Exchange Commission des États-Unis
- Mises à jour
- d'habitude
- Vérification
- vision
- Quoi
- WHO
- gagnants
- sans
- des mots
- Activités:
- partout dans le monde
- années