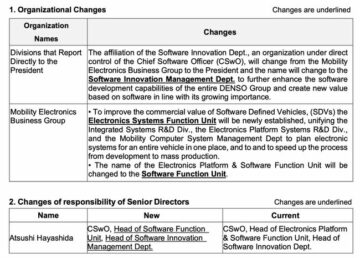
TOKYO, 19 janvier 2022 - (JCN Newswire) - Eisai Co., Ltd. a annoncé aujourd'hui que l'unité d'essais du réseau Dominantly Inherited Alzheimer Network (DIAN-TU), dirigée par la Washington University School of Medicine à St. Louis, a inscrit le premier sujet de l'étude de phase II/III (étude Tau NexGen). L'étude évaluera l'effet de l'anticorps tau E2814 anti-région de liaison aux microtubules (MTBR) expérimental d'Eisai, dans la maladie d'Alzheimer héréditaire dominante (DIAD).
Les personnes qui ont des mutations génétiques de DIAD sont connues pour développer la maladie d'Alzheimer (MA) et développeront probablement des symptômes à peu près au même âge que leurs parents affectés, souvent dans la cinquantaine, la quarantaine ou même la trentaine. Les principales pathologies de la maladie d'Alzheimer sont la plaque amyloïde constituée d'agrégats bêta-amyloïde (Abêta) ; enchevêtrements neurofibrillaires; et des agrégats intraneuronaux de tau, dont on pense qu'ils se propagent tous dans tout le cerveau.
Le but de l'étude Tau NexGen est d'évaluer l'innocuité, la tolérabilité, le biomarqueur et l'efficacité cognitive des thérapies expérimentales chez les participants pré-symptomatiques ou symptomatiques qui ont une mutation génétique causant la MA. En mars 2021, le DIAN-TU a sélectionné E2814, qui a été créé à partir d'une collaboration de recherche entre Eisai et l'University College London, comme premier médicament expérimental parmi les médicaments anti-tau pour l'étude Tau NexGen. Avec de plus en plus de preuves provenant d'études cliniques montrant que le ciblage de l'amyloïde peut réduire les biomarqueurs de la maladie d'Alzheimer, les responsables de l'essai clinique Tau NexGen ont sélectionné le lecanemab (BAN2401), l'anticorps expérimental anti-protofibrille Abeta d'Eisai, comme traitement anti-amyloïde de fond, et la conception de l'étude a été modifiée en novembre. 2021.
Eisai positionne la neurologie comme un domaine thérapeutique clé et continuera à innover dans le développement de nouveaux médicaments basés sur la recherche de pointe en neurologie, car elle cherche à contribuer davantage à l'amélioration des avantages des personnes touchées et de leurs familles dans les maladies à haut niveau non satisfait. besoins, tels que la démence, y compris la MA.
À propos du Réseau Alzheimer à héritage dominant (DIAN)
Le DIAN est un effort de recherche international axé sur la maladie d'Alzheimer à transmission dominante. La maladie d'Alzheimer à transmission prédominante (DIAD) est une forme rare de la maladie d'Alzheimer (MA) qui provoque une perte de mémoire et une démence chez les individus, généralement entre 30 et 50 ans. La maladie touche moins de 1 % de la population totale des personnes atteintes de la maladie d'Alzheimer. L'Unité d'Essais du Réseau Alzheimer Dominante Inhéréditaire (DIAN-TU) a pour objectif de trouver des solutions pour traiter ou prévenir cette maladie et, potentiellement, toutes les formes d'Alzheimer. Le DIAN-TU est un partenariat international public-privé dédié à la conception et à la gestion d'essais thérapeutiques interventionnels pour les personnes atteintes et à risque de DIAD.
À propos de l'étude Tau NexGen
Le but de l'étude Tau NexGen est d'évaluer l'innocuité, la tolérabilité, le biomarqueur et l'efficacité cognitive des thérapies expérimentales chez les personnes atteintes d'une mutation génétique causant la MA. Dans l'étude Tau NexGen, les participants symptomatiques recevront le lecanemab, un anticorps anti-bêta-amyloïde (Abêta) protofibrille pendant six mois avant d'être assignés au hasard pour recevoir également le médicament anti-tau ou un placebo. Étant donné que les plaques amyloïdes s'accumulent avant les enchevêtrements de tau dans la MA, cette conception de l'étude permet aux chercheurs d'évaluer si l'élimination de l'amyloïde ouvre la voie au fonctionnement le plus efficace du médicament anti-tau. Les participants pré-symptomatiques seront assignés au hasard pour recevoir le médicament anti-tau ou un placebo pendant un an avant de commencer l'administration du lecanemab. En échelonnant ainsi les médicaments, les chercheurs pourront évaluer les effets du médicament anti-tau seul avant d'évaluer les effets des deux médicaments ensemble. Si les critères d'évaluation primaires et secondaires sont positifs dans l'analyse deux ans après le début de l'étude, l'étude sera prolongée de deux ans supplémentaires pour évaluer si le médicament ralentit le déclin cognitif et a d'autres effets sur la pathologie tau.
À propos d'E2814
Un anticorps tau expérimental de la région de liaison anti-microtubule (MTBR), E2814, est en cours de développement en tant qu'agent modificateur de la maladie pour les tauopathies, y compris la MA sporadique. Des études cliniques de phase I sont en cours. E2814 a été découvert dans le cadre de la collaboration de recherche entre Eisai et University College London. E2814 est conçu pour empêcher la propagation des graines de tau dans le cerveau des individus affectés.
À propos du Lécanemab (BAN2401)
Lecanemab est un anticorps monoclonal humanisé expérimental pour la MA qui est le résultat d'une alliance de recherche stratégique entre Eisai et BioArctic. Le lecanemab se lie sélectivement pour neutraliser et éliminer les agrégats Abeta toxiques solubles (protofibrilles) qui sont censés contribuer au processus neurodégénératif.
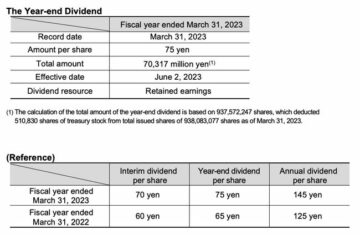
en addition. En tant que tel, le lecanemab peut avoir un effet sur la pathologie de la maladie et ralentir la progression de la maladie. En ce qui concerne les résultats de l'analyse pré-spécifiée à 18 mois de traitement, l'étude 201 a démontré une réduction de l'accumulation d'Abêta dans le cerveau (P<0.0001) et un ralentissement de la progression de la maladie mesurés par ADCOMS* (P<0.05) chez les sujets AD au début. L'étude n'a pas atteint son critère de jugement principal** à 12 mois de traitement. L'extension en ouvert de l'étude 201 a été initiée après la fin de la période principale et d'une période d'interruption sans traitement (moyenne de 24 mois) pour évaluer l'innocuité et l'efficacité, et est en cours.
Eisai a obtenu les droits mondiaux d'étude, de développement, de fabrication et de commercialisation du lecanemab pour le traitement de la MA conformément à un accord conclu avec BioArctic en décembre 2007. En mars 2014, Eisai et Biogen ont conclu un accord de développement et de commercialisation conjoint pour le lecanemab et les parties a modifié cet accord en octobre 2017. Actuellement, le lecanemab fait l'objet d'une étude clinique pivot de Phase III dans la MA précoce symptomatique (Clarity AD), suite aux résultats de l'étude clinique de Phase II (Étude 201). En juillet 2020, l'étude clinique de phase III (AHEAD 3-45) pour les personnes atteintes de MA préclinique, ce qui signifie qu'elles sont cliniquement normales et ont des niveaux intermédiaires ou élevés d'amyloïde dans leur cerveau, a été lancée. AHEAD 3-45 est mené dans le cadre d'un partenariat public-privé entre l'Alzheimer's Clinical Trial Consortium qui fournit l'infrastructure pour les essais cliniques universitaires sur la MA et les démences associées aux États-Unis, financé par le National Institute on Aging, qui fait partie des National Institutes of Health , et Eisai.
En septembre 2021, une soumission continue à la FDA d'une demande de licence de produits biologiques (BLA) pour le traitement de la MA précoce dans le cadre de la voie d'approbation accélérée a été lancée. Lecanemab a obtenu la désignation de Breakthrough Therapy en juin 2021, un programme de la Food and Drug Administration (FDA) des États-Unis visant à accélérer le développement et l'examen de médicaments pour des maladies graves ou potentiellement mortelles.
* Développé par Eisai, ADCOMS (AD Composite Score) combine les items des échelles ADAS-Cog (Alzheimer's Disease Assessment Scale-cognitive subscale), CDR (Clinical Dementia Rating) et MMSE (Mini-Mental State Examination) pour permettre une détection sensible des changements dans les fonctions cliniques des premiers symptômes de la MA et des changements dans la mémoire.
** Une probabilité estimée de 80 % ou plus de démontrer un ralentissement de 25 % ou plus du déclin clinique à 12 mois de traitement, mesurée par l'ADCOMS par rapport à l'inclusion par rapport au placebo
Demandes des médias:
Département des relations publiques, Eisai Co., Ltd.
+81-(0)3-3817-5120
Eisai Inc (États-Unis) Libby Holman 201-753-1945
Libby_Holman@eisai.com
Contact Investisseurs:
Eisai Co., Ltd.
Département des relations investisseurs
TEL: +81-(0)70-8688-9685
Copyright 2022 JCN Newswire. Tous les droits sont réservés. www.jcnnewswire.comEisai Co., Ltd. a annoncé aujourd'hui que l'unité d'essais du réseau Dominantly Inherited Alzheimer Network (DIAN-TU), dirigée par la Washington University School of Medicine à St. Louis, a inscrit le premier sujet dans l'étude de phase II/III (étude Tau NexGen). Source : https://www.jcnnewswire.com/pressrelease/72519/3/
- 2020
- 2022
- Ad
- administré
- contrat
- Tous
- Alliance
- parmi
- selon une analyse de l’Université de Princeton
- annoncé
- Candidature
- Réservé
- autour
- moyen
- Baseline
- Début
- va
- qui ne s'occupent pas de leur chez-soi.
- bêta
- essais cliniques
- cognitif
- collaboration
- Université
- continuer
- droit d'auteur
- Conception
- conception
- Détection
- développer
- développé
- Développement
- DID
- découvert
- Maladie
- maladies
- down
- drogue
- Médicaments
- "Early Bird"
- effet
- familles
- fda
- Prénom
- concentré
- nourriture
- formulaire
- fonction
- Financé
- écart
- Global
- Santé
- Haute
- HTTPS
- Y compris
- Infrastructure
- Innovation
- International
- IT
- Juillet
- clés / KEY :
- LED
- Licence
- London
- majeur
- Mars
- Marché
- médecine
- Mémoire
- mois
- (en fait, presque toutes)
- Nationales
- réseau et
- parents
- Partenariat
- Personnes
- phase
- pivot
- population
- processus
- Programme
- fournit
- réduire
- un article
- Résultats
- Avis
- Analyse
- Sécurité
- L'école
- secondaire
- graines
- choisi
- SIX
- Le ralentissement de la
- Solutions
- propagation
- Commencer
- Région
- Stratégique
- et le cannabis
- Étude
- aujourd'hui
- ensemble
- traiter
- traitement
- procès
- nous
- université
- Washington
- WHO
- dans les
- an
- années