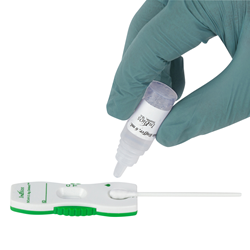
SCoV-2 Ag Mendeteksi Tes Cepat
SEATTLE (PRWeb) 22 Agustus 2021
InBios International Inc., pengembang terkemuka tes diagnostik untuk penyakit menular yang baru muncul, hari ini mengumumkan bahwa penelitian laboratorium menyarankannya SCoV-2 Ag Mendeteksi Tes Cepat akan mendeteksi varian Delta (garis keturunan B.1.617.2), yang bertanggung jawab atas peningkatan cepat infeksi dan kematian di AS dan di seluruh dunia. Studi awal menunjukkan bahwa tes antigen titik perawatan InBios akan mendeteksi varian Delta pada tingkat yang mirip dengan isolat USA-WA1-2020 yang digunakan untuk mengembangkan pengujian.
“Memiliki tes cepat yang dapat mendeteksi varian Delta dengan cepat dan akurat sangat penting karena varian ini terbukti sangat mudah menular dan menyebar dengan cepat,” kata Dr. Syamal Raychaudhuri, Chief Scientific Officer InBios. “Kami senang bahwa penelitian menunjukkan bahwa tes cepat kami dapat menjadi alat diagnostik yang hebat dalam menentukan varian Delta, yang terbukti menjadi tantangan terbesar saat ini dalam perang melawan COVID-19.”
Menurut Pusat Pengendalian dan Pencegahan Penyakit, varian Delta lebih menular dan menyebabkan peningkatan penularan bila dibandingkan dengan varian lain, bahkan pada individu yang divaksinasi. Varian Delta, pertama kali diidentifikasi di India, kini diperkirakan mencapai 86% dari semua kasus COVID-19 berurutan di AS. Untuk pertama kalinya sejak Februari, Amerika Serikat rata-rata lebih dari 100,000 kasus COVID-19 baru setiap hari.
Di Bios SCoV-2 Ag Mendeteksi Tes Cepat menerima Emergency Use Authorization (EUA) dari US Food and Drug Administration (FDA) pada Mei 2021. Pendanaan untuk mencapai EUA untuk SCoV-2 Ag Detect Rapid Test sebagian berasal dari kontrak $12.7 juta dengan US Army Medical Material Development Activity dengan dana yang disediakan oleh Badan Kesehatan Pertahanan (DHA) melalui Undang-Undang CARES dan Otoritas Penelitian dan Pengembangan Biomedis Lanjutan (BARDA) Departemen Kesehatan dan Layanan Kemanusiaan (BARDA) diberikan pada tahun 2020. Tes ini sederhana dan cepat – patennya menunggu keputusan desain fitur usap hidung langsung ke format kaset. Ini tidak memerlukan langkah instrumentasi atau media transportasi dan dapat dilakukan di tempat dengan hasil yang dikirimkan dalam waktu sekitar 20 menit.
Produk ini belum disetujui atau disetujui FDA tetapi telah disahkan oleh FDA di bawah EUA untuk digunakan oleh laboratorium resmi. Produk ini hanya diizinkan untuk mendeteksi protein dari SARS-CoV-2, bukan untuk virus atau patogen lain. Penggunaan darurat produk ini hanya diizinkan selama pernyataan bahwa ada keadaan yang membenarkan otorisasi penggunaan darurat diagnostik in vitro untuk deteksi dan/atau diagnosis COVID-19 berdasarkan Bagian 564(b)(1) dari Federal Undang-Undang Makanan, Obat-obatan dan Kosmetik, 21 USC 360bbb-3(b)(1), kecuali jika deklarasi dihentikan atau otorisasi dicabut lebih cepat.
Untuk informasi lebih lanjut tentang tes InBios COVID-19, kunjungi: http://www.inbios.com/covid-19/.
Untuk informasi lebih lanjut tentang COVID-19, silakan kunjungi http://www.cdc.gov or http://www.who.int.
Tentang InBios: InBios International Inc. mengkhususkan diri dalam desain, pengembangan dan pembuatan tes diagnostik untuk penyakit menular yang muncul dan biothreats. Terletak di Seattle, Washington, InBios menawarkan produk kualitas unggul yang akurat, mudah digunakan dan hemat biaya. InBios mematuhi GMP, terdaftar FDA, berlisensi USDA, dan bersertifikat ISO 13485:2016. Untuk informasi lebih lanjut, kunjungi http://www.inbios.com
Bagikan artikel di media sosial atau email:
