חומרים
ממסים וריאגנטים נרכשו ממקורות מסחריים והשתמשו בהם כפי שהתקבלו, אלא אם צוין אחרת. מתנול (דרגת ריאגנט ACS) הושג מ- Fisher Scientific. אקרילאמיד בדרגת ביולוגיה מולקולרית (מספר קטלוגי A9099), נתרן אקרילט (מספר קטלוגי 408220), 19:1 אקרילאמיד/ביס-אקרילאמיד (מספר קטלוגי A2917) ואמוניום פרסולפט (APS; מספר קטלוגי A3678) נרכשו מ-Sigma-Aldrich. טהור במיוחד N,N,N′,N′-tetramethylethylenediamine (TEMED; מספר קטלוגי 15524010) ו-SYBR Gold Nucleic Acid Gel Stain (מספר קטלוגי S11494) התקבלו מ-Thermo Scientific. אוליגונוקלאוטידים מומלחים נרכשו מ-Integrated DNA Technologies (IDT). גז חנקן (>99.999%) שימש בתנאים אינרטיים וסופק על ידי מחולל גז פנימי. כדי להבטיח מצב אינרטי, הוא טוהר באמצעות מלכודת חמצן דגם 1000 מבית Sigma-Aldrich (מספר קטלוגי Z290246). ריאגנטים עם קבוצות אקרילאמיד שלא הגיבו אוחסנו ב-4 °C או −20 °C, מוגנים מפני חשיפה מיותרת לאור. חלבון אקטין (>95% טהור, שריר שלד ארנב, מספר קטלוגי AKL95) התקבל מ-Cytoskeleton ו-DNase I (מספר קטלוגי M0303) התקבל מ-New England Biolabs. מטריגל התקבלה מקורנינג (מספרי קטלוג 354277 ו-356231). סולמות DNA נרכשו מ-Thermo Fischer (מספר קטלוג SM1211).
מקורות תאים
MSCs שמקורם במח עצם אנושי בודדו מתורמות בריאות (בני 26-37) עם הסכמה מדעת על ידי הפקולטה לרפואה בבית החולים האוניברסיטאי דרזדן (Ethikkommission an der Technischen Universität Dresden, מספר מועצת האתיקה EK263122004). תאי MDCK II (ECACC 00062107) סופקו על ידי הקבוצה של A.H.. תאי גזע פלוריפוטנטיים אנושיים נוצרו במתקן להנדסת תאי גזע CRTD, Technische Universität Dresden, על ידי Shahryar Khattak ונרשמו תחת השם hPSCreg CRTDi003-B (https://hpscreg.eu/cell-line/CRTDi003-B). קו CT27 תאי גזע טרופובלסט (TSC) שמקורו במטופל במחקר זה התקבל מבנק תאי הגזע של RIKEN (https://cellbank.brc.riken.jp/cell_bank/CellInfo/?cellNo=RCB4936). ה-CT27 TSCs נגזרו מתאי ציטוטרופובלסט שליה כמתואר ב- ref. 62. שליות אנושיות התקבלו מנשים בריאות עם הסכמה מדעת חתומה של התורמים, ואישור ועדת האתיקה של בית הספר לרפואה של אוניברסיטת טוהוקו (רישיון מחקר 2014-1-879).
סינתזה של פולימרים
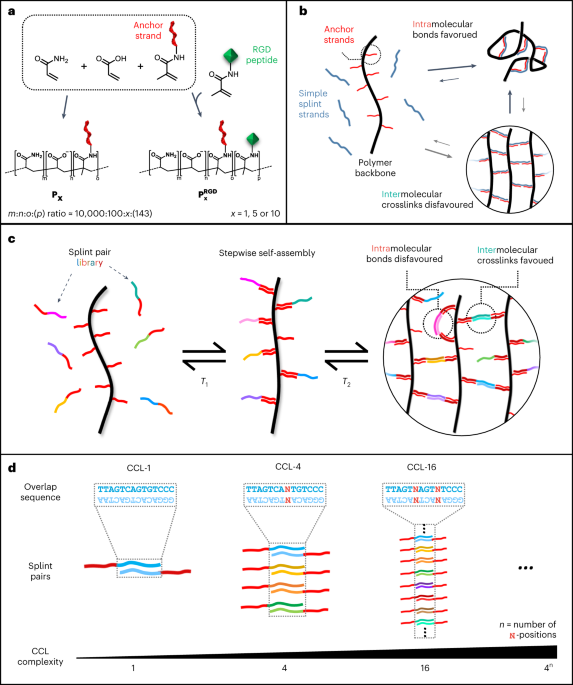
פרוטוקול מפורט זמין ב- ref. 1) עברו פוליממור במשותף במאגר TBE (100'mM Tris, 100'mM חומצה בורית, 2'mM EDTA, pH 8.2). ל P1, P5 ו P10, ריכוזי ה-DNA בתמיסה היו 100 µM, 500 µM ו-1,000 µM, בהתאמה. עבור הנגזרות המתאימות עם פונקציונליות RGD ({{bf{P}}}_{{bf{5}}}^{{bf{RGD}}}) ו ({{bf{P}}}_{{bf{10}}}^{{bf{R}}{bf{G}}{bf{D}}}), 10 mM של פפטיד RGD אקרילי (רצף, G(acryl-K)GGGRGDSP) עבר פוליממור יחד עם התמיסה שלעיל. תגובות פילמור עבור P1, P5 ו ({{bf{P}}}_{{bf{5}}}^{{bf{RGD}}}) הופעלו עם 0.005 wt% APS בנוכחות 0.005 wt% TEMED. סינתזה של P10 ו ({{bf{P}}}_{{bf{10}}}^{{bf{R}}{bf{G}}{bf{D}}}) הופעל על ידי 0.025 wt% TEMED ו-0.025 wt% APS. כדי להשיג משקל מולקולרי גבוה ופיזור גודל צר, היה צורך לבצע את התגובה בגז חנקן בעל טוהר גבוה, שהועבר דרך מלכודת חמצן באתר. התגובה הורשה להימשך בן לילה, וכתוצאה מכך תמיסת פולימר צמיגית ביותר המעידה על היווצרות של שרשראות פולימר ארוכות. נעשה שימוש בספקטרוסקופיה NMR כדי לאמת המרה גבוהה של המונומר (איור משלים. 3). התמיסה דוללה ב-9 נפחים של חיץ TE (10 mM Tris, 1 mM EDTA, pH 8.0) ולאחר מכן טוהרה באמצעות משקעים מתנול. הגלולה הושעתה מחדש במים milliQ ואוחסנה במנות ב-20 מעלות צלזיוס. מנה קטנה של תמיסת הפולימר עברה ליאופיל ושקללה כדי לקבוע את תפוקת הסינתזה. תשואות: 89% (P1), 98% (P5), 93% (P10), 92% (({{bf{P}}}_{{bf{5}}}^{{bf{RGD}}})) ו- 88% (({{bf{P}}}_{{bf{10}}}^{{bf{R}}{bf{G}}{bf{D}}})).
תחזיות תרמודינמיות של השכן הקרוב ביותר
רצפים מפורשים של גדילים צולבים וההשלמות שלהם נוצרו באמצעות סקריפט Python מותאם אישית. התוכנית מחליפה ברצף את הבסיסים המעורפלים N עם נוקלאובסיסים (A, C, G, T) באמצעות לולאות מקוננות רב-שכבתיות. זה יצר ספרייה של גרסאות של סד קדימה ואחורה. האנרגיות החופשיות המינימליות (MFEs) של כל תחומי החפיפה המפורשים חושבו מול כל תחומי החפיפה המפורשת בספרייה באמצעות NUPACK (גרסה 4.0.0.27), תוך שימוש בפרמטרים תרמודינמיים הקרובים ביותר לפי ref. 63. הפרמטרים של הדגם נקבעו ל T = 20 °C, 150 mM NaCl, 75 µM ריכוז DNA כולל (37.5 µM לכל גדיל סד), וגודל מורכב של 2. לכל זוג אפשרי, גורם ההפצה של בולצמן Bx,y חושב ברצף עבור כל גרסה של קדימה (x) כנגד כל סד הפוך אפשרי (y) גדיל בריכוז התיאורטי הצפוי באמצעות המשוואה
$${B}_{x,y}={rm{e}}^{-{{rm{MFE}}(x,y)}/{kT}}$$
איפה k הוא קבוע בולצמן. ההתפלגות המנורמלת חושבה כדי לחקור את הזיקה הסלקטיבית של כל וריאנט סד קדימה במאגר של רצפי סד הפוכים. זה חושב עבור כל זוג כיחס בין גורם ההתפלגות של זוג אחד (x, y) לפי סכום כל הזוגות כ
$${B}_{x,y}^{{mathrm{normalized}}}=frac{{B}_{x,y}}{{sum }_{y}{B}_{x,y} }$$
נציין כי ניתן להשיג פתרון מדויק רק על ידי פתרון מספרי של מערכת משוואות דיפרנציאליות רגילות63. לשם הפשט, הנחנו שכל גדיל סד זמין בריכוז הראשוני שלו. במציאות, ריכוזי גדילי סד לא משלימים צפויים להיות מופחתים באופן משמעותי, מכיוון שהם ייספגו בעיקר על ידי שותפיהם המחייבים המשלימים. הערכים שהתקבלו עבור זוגות CCL ספציפיים בהתפלגות בולצמן המבוססים על החישוב הפשוט שלנו נחשבים אפוא לגבול תחתון לשפע יחסי.
חישול תרמי של הידרוג'לים מוצלבים ב-DNA
אלא אם צוין, הדגימות הוכנו בריכוז סופי של תמיסת פולימר של 1% (w/v), בתוספת שווה ערך אחת של מצלבות DNA לגדיל העוגן (לדוגמה, 75 μM מצלבות עבור 1% (w/v) P5 פתרון), במצב חיץ של 150 mM NaCl ו-1x חיץ TE. הדגימות חוסלו על המחזור התרמי באמצעות השלבים הבאים: (1) חימום ב-95 מעלות צלזיוס למשך 3 דקות, (2) קירור מיידי מ-95°C ל-80°C, (3) שמירה על 80°C למשך 2 דקות , (4) כבש קירור ראשון מ-80°C ל-65°C ב-0.3 °C דקה-1, (5) רמפת קירור שניה מ-65°C ל-37°C ב-0.5°C min.-1, (6) שמירה על 37 מעלות צלזיוס למשך 24 שעות.
רמפת הקירור הראשונה מאפשרת קישור של תחומי המתאמים של ה-crosslinkers לגדילי העוגן, בעוד שהרמפה השנייה מאפשרת קשירה נכונה של תחומי החפיפה לשותפים המשלימים שלהם.
מדידות ראולוגיות מתנודות
מדידות צמיגות נערכו באמצעות ריאומטר Anton Paar MCR301 עם גיאומטריית לוחית קונוס בקוטר 25 מ"מ (זווית חרוט 0.5°). בקרת הטמפרטורה הובטחה על ידי התקנת מערכת Peltier PTD-200 (Anton Paar) בתוך אזור המדידה. כדי לשמור על לחות גבוהה ולמנוע חפצי אידוי, הונח גליל נייר רטוב סביב היקף הצלחת. סוויפי משרעת בוצעו מ-0.1% ל-1,000% מתח ב-1.6 Hz, בעוד שסוויפי תדר בוצעו מ-0.1 Hz ל-100 Hz ב-10% מתח. ניקוי הטמפרטורה כיסו טווח שבין 4 °C ל-60 °C ב-10% מתח, ואחריו 60 °C עד 70 °C ב-20% מתח, הכל ב-1.6 Hz. שלבי החימום והקירור בוצעו באופן הפיך במשך שני מחזורים כדי לא לכלול חפצי אידוי. אלא אם צוין, דגימות נמדדו בשלושה עותקים לצורך שחזור. תכונות הרפיית מתח נמדדו ב-15% מתח, כאשר המתח נשמר קבוע תוך רישום מתח גזירה לאורך זמן. בדיקות ריפוי עצמי כללו מתח לסירוגין בין 1,000% ל-10% במשך 5 דקות כל אחת, חזרה 4.5 פעמים בתדר של 1.6 Hz. עבור בדיקות הג'ל המופעלות בחום, הוכנו שני מבשרים בתמיסת פולימר של 1% (w/v) בתוספת: (1) גדילי CCL-40 קדמיים של 4 µM (גדיל מזהה 4a) וגדיל חוסם תואם 80 µM (מזהה גדיל 14a), ו-(2) ספריית CCL-40 הפוכה של 4 µM (גדיל מזהה 4b) ו-80 µM גדיל חסימה תואם (גדיל מזהה 14b). המבשרים חוממו ב-95 מעלות צלזיוס למשך 3 דקות, חוסלו באיטיות עם רמפת קירור מ-95 מעלות צלזיוס ל-4 מעלות צלזיוס ב-3 מעלות צלזיוס דקות.-1, ונשמר ב-4 °C למשך הלילה. לפני המדידה, שני הפרקורסורים היו מעורבים והוחלו על ה-rheometer. הדגימות הוחזקו ב-4 מעלות צלזיוס למשך 5 דקות, חוממו במהירות ל-37 מעלות צלזיוס ונשמרו בטמפרטורה של 37 מעלות צלזיוס למשך 60 דקות עם גזירה במתח של 10% ותדירות של 1.6 הרץ.
הדפסת הידרוג'ל
שקופית זכוכית מיקרוסקופית (76 × 26 mm, Thermo Scientific) הוצמדה למצע ההדפסה ב-BioScaffolder BS5.1 (GeSiM). מאתיים מיקרוליטר של DyNAtrix (1% (w/v) P5 + CCL-64) שנצבע ב-SYBR Gold הועבר למזרק חד פעמי של 1 ml (Omnican 40). כדי להסיר בועות אוויר, המזרק עבר צנטריפוגה הפוך ב-300g למשך 2 דקות. ההידרוג'לים הודפסו דרך מחט בגודל 30 (אומניקן) בטמפרטורת החדר, עם מהירות הדפסה של 2 מ"מ שניות-1, קצב שחול של 40 μm s-1 וגובה שכבה של 0.12 mm. המבנים התלת-ממדיים שהתקבלו, בגודל של 3 × 20 × 20 mm (L × W × H), צולמו במיקרוסקופ קונפוקאלי של Opera Phenix (PerkinElmer) בהגדלה של ×5.
ערבוב מבחני הומוגניות
שתי תמיסות מבשר הוכנו במאגר TE 1x בריכוז סופי של 1% (w/v) P5 נוספו עם: (1) גדילי CCL-40 קדימה של 64 µM (גדיל מזהה 6a) ו-80 µM גדיל חסימה תואם (גדיל מזהה 15a), ו-(2) ספריית CCL-40 הפוכה של 64 µM (גדיל מזהה 6b) ו-80 µM מקבילים גדיל חסימה (מזהה גדיל 15b). עשרה מיקרומולר של גדיל 6-FAM (פלואורסצין) שונה (גדיל מזהה 15) נוספו למבשר (1). לאחר 1 שעה של איזון ב-4 מעלות צלזיוס, שני המבשרים היו מעורבבים באמצעות פיפטה תזוזה חיובית. התערובת חולקה לצלחת בעלת 384 בארות (Greiner Bio-One) בנפח של 10 µl לבאר. הצלחת הודגרה בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות כדי להתחיל ג'לציה. לבסוף, תמונות נרכשו במיקרוסקופ קונפוקאלי של Andor Dragonfly (מכשיר אוקספורד) בהגדלה של ×4.
בדיקת עיכול אנזימטית
ה-Forster-resonance-energy-transfer-paigue oligos, ששונו עם Cy5 fluorophore ו-Iowa Black Dark Quencher (Q), נרכשו מ-IDT. תערובת של 2 µM Cy5-גדיל (גדיל מזהה 13a) ו-4 µM Q-גדיל (גדיל מזהה 13b) הוכנה במאגר PBS 1x ונתונה לשלבי חישול: חימום ב-95°C למשך 1 דקה, קירור מיידי ל-50 ° C למשך 2 דקות וקירור הדרגתי מ-50°C ל-20 °C בקצב של −1.5°C min-1. דגימות הוכנו עם ריכוז סופי של 100 nM Cy5-Q Förster-resonance-energy-transfer-probe ותכולת אקטין משתנה מ-2.5 µg ml-1 ל-320 µg ml-1 (שלד שלד, מספר קטלוגי AKL95-B) במאגר המכיל 150'mM NaCl, 1.8'mM CaCl2, 0.2 mM ATP (Jena Bioscience, מספר קטלוגי NU-1010) ו-1x IDTE. לפני המדידה, 80 U ml-1 DNase I (NEB, מספר קטלוגי M0303S) נוספה לכל דגימה. כל דגימה הוטענה בשלושה עותקים בנפח של 20 µl לבאר לתוך צלחת PCR כמותית של 96 בארות. אותות הקרינה נרשמו כל 10 דקות במשך 24 שעות, ולאחר מכן כל 30 דקות במשך 36 השעות הבאות ב-37 מעלות צלזיוס באמצעות Bio-Rad CFX96 Real-Time PCR System.
נפח ג'ל ומדידות עיכול
חלבון האקטין הליאופיל (Cytoskeleton, מספר קטלוגי AKL95-B) שוחזר עם 100 µl מים מפושטים לריכוז של 10 mg ml-1. האקטין המשוחזר היה אז במאגר המכיל 5'mM Tris-HCl pH 8.0, 0.2'mM CaCl2, 0.2 mM ATP, 5% (w/v) סוכרוז ו-1% (w/v) דקסטרן. אבקת חומצת לימון (192.124 MW) הוכנה ב-1x PBS לריכוז סופי של 200 mM, pH 7.0. הג'ל (1% (w/v) P5 מקושרים עם CCL-64) נצבעו ב-10X SYBR Gold לפני התנפחות. לאחר מכן, הג'ל הועבר לצלחת בעלת 384 בארות (Greiner, מספר 788092) בנפח של 5 µl לבאר. הדגימות הוטבלו ב-20 µl של (1) 1x TE חיץ, (2) DMEM המכיל 10% FBS, (3) 50 µg ml-1 actin + 10% DMEM המכיל FBS, או (4) 10 mM ציטראט + 10% DMEM המכיל FBS. התמונות נלכדו כל שעה במשך 48 שעות ב-37 מעלות צלזיוס במיקרוסקופ קונפוקאלי של Opera Phenix Plus (PerkinElmer) בהגדלה של ×5. נפח הג'ל הוכמת באמצעות תוכנת IMARIS (Oxford Instrument) באמצעות אשף השטח והכלי הסטטיסטי תחת הגדרת סף אחידה.
דגירה של דם מלא
דגירה של דם מלא בוצעה כמתואר קודם לכן64,65. ג'לים הוכנו על מנשאי זכוכית עם פוליאתילן-גובה-שכבת מליטה אנהידרידית66, והוכנס לתאי דגירה שפותחו בבית העשויים מפוליטטראפלואורואתילן, כאשר 3.2 ס"מ2 משטח הבדיקה נחשף לדם של 2 מ"ל64. זכוכית מנוקה באופן ריאקטיבי67 וטפלון AF (DuPont) שימשו כמשטחי התייחסות מפעילים ואינרטיים, בהתאמה.
דם התקבל משני תורמים מרצון התואמים ABO שלא השתמשו בשום תרופה בעשרת הימים האחרונים. הדם נוגד קרישה מיד עם 1.0 U ml-1 הפרין (Ratiopharm), אסוף וממולא לתוך תאי הדגירה עם הדגימות, תוך הימנעות מממשק אוויר. החדרים הודגרו במשך 2 שעות בטמפרטורה של 37 מעלות צלזיוס בסיבוב תקורה קבוע כדי למנוע שיקוע. הדם נותח לאחר מכן עבור ספירת תאי הדם (Beckmann Coulter AcTdiff). הפעלת גרנולוציטים ומונוציטים נקבעו על ידי ציטומטריית זרימה (LSR Fortessa, Becton Dickinson), כאשר גרנולוציטים ומונוציטים זוהו על פי מאפייני הפיזור שלהם ו-CD15 (שיבוט SSEA-1, PE-מצומד, BioLegend) ו-CD14 (משובט M5E2, APC מצומד, בקטון דיקינסון) חיוביות, בהתאמה. עוצמת הביטוי של CD11b (שיבוט ICRF44, PacificBlue-conjugated, BioLegend) נורמלה לדם שהודגרה עם 100 EU ml-1 אנדוטוקסין. שיעור הגרנולוציטים עם CD11b המופעל באופן קונפורמטיבי נקבע באמצעות שיבוט אנטי-CD11b CBRM1/5 (PE/Cy7-conjugated, BioLegend).
סמנים מסיסים של הפעלת קרישה (שבר פרוטרומבין F1+2), הפעלת טסיות דם (גורם טסיות דם 4 (PF4)) והפעלת משלים (שבר משלים C5a) נקבעו מפלסמה באמצעות מבחני אימונוסורבנט מסחריים הקשורים לאנזים (ELISAs; Enzygnost F1+2 , Siemens Healthineers; Zymutest PF4, Hyphen BioMed; C5a ELISA, DRG Instruments) לאחר ייצוב הדם עם התוספים המומלצים של ערכות הבדיקה וצנטריפוגה.
הניתוח בוצע עם סט משולש של דגימות במקביל (n = 3). המחקר כוסה בהצבעה האתית EK-BR-24/18-1 של Sächsische Landesärztekammer.
תרבות תאים תלת ממדית
פרוטוקול מפורט זמין ב שיטות משלימות. בקצרה, רכיבי ג'ל הומסו במים ואוחסנו ב-20 מעלות צלזיוס לתרבית תאים. עבור תרביות MSC ו-hiPSC, שני מבשרים הוכנו בריכוז סופי של 1% (w/v) ({{bf{P}}}_{{bf{5}}}^{{bf{RGD}}}) עם: (1) 37.5 µM סד קדימה (גדיל מזהה 6a) ו-75 µM גדיל חוסם (גדיל מזהה 15a), ו-(2) גדילי סד הפוך באורך 37.5 µM (גדיל מזהה 6b) וגדיל חוסם 75 µM (גדיל מזהה 15b). באשר לתרביות MDCKII ו-hTSC, שני מבשרים הוכנו בריכוז סופי של 1% (w/v) ({{bf{P}}}_{{bf{10}}}^{{bf{RGD}}}) עם: (1) סד קדמי של 75 µM (גדיל מזהה 6a) וגדיל חוסם 150 µM (גדיל מזהה 15a), ו-(2) גדילי סד הפוך באורך 75 µM (גדיל מזהה 6b) וגדיל חוסם 150 µM (גדיל מזהה 15b). DMEM מרוכז נוסף כדי להגיע לריכוז סופי של פי 1. המבשרים עברו איזון ב-4 מעלות צלזיוס למשך הלילה כדי שהגדילים החוסמים ייקשרו כמותית לגדילי הסד.
תרחיף התא היה מעורבב עם המבשר הראשון (1) ולאחר מכן עם המבשר השני (2). הידרוג'לים עמוסי תאים (5 µl לבאר) הונחו בצלחות 384-בארות או הוספת מיקרו-בארים (ibidi, מספר קטלוגי 80409) המחוברים בצלחות 6-בארות. הדגימות הודגרו ב-37 מעלות צלזיוס למשך 30 דקות כדי להפעיל ג'לציה המופעלת בחום. לאחר הג'ל, הוסף מדיום תרבית בודד לכל באר. בעת שימוש במדיום המכיל סרום, 100 µg ml-1 של אקטין (Cytoskeleton, מספר קטלוגי AKL95) נכלל כדי לדכא פעילות נוקליאז. התאים המשובצים תורבו ב-37 מעלות צלזיוס, 5% CO2.
עבור קבוצות Matrigel, תאים הוטמעו ב-50% Matrigel. צפיפות זריעת התא, זמן הג'ל והמדיום היו זהים לדגימות DyNAtrix.
בדיקת פלואורסצנטי חי/מת ושחרור תאים
MSCs נצבעו ב-3 µM calcein AM (PromoKine, מספר קטלוגי PK-CA707-80011) ו-0.75 µM Draq7 (Invitrogen, מספר קטלוגי D15106) במדיום למשך 30 דקות ב-37 °C, 5%2. תמונות קונפוקאליות צולמו במיקרוסקופ קונפוקאלי של Opera Phenix Plus (PerkinElmer) בהגדלה של ×10. ספירת תאים בוצעה עם תוכנת IMARIS (Oxford Instrument) באמצעות אשף הכתמים. כדאיות התא נקבעה על ידי חלוקת מספר התאים החיים בסכום התאים החיים והמתים.
לשחרור תאים, 2 U לכל באר DNase I נוספו לאחר שה-MSCs נצבעו ב-3 µM calcein AM למשך 30 דקות. תמונות קונפוקאליות נרכשו כל 20 דקות בהגדלה של ×5 למשך 2 שעות ב-37 מעלות צלזיוס עם 5% CO2.
צביעה אימונופלואורסצנטית
hiPSCs תוקנו עם 2% paraformaldehyde למשך 40 דקות בטמפרטורת החדר, ולאחר מכן פרמיביליזציה וחסימה עם 0.1% Triton X-100 ב-2% BSA/PBS למשך 1 h °C. לאחר מכן התאים הודגרו למשך הלילה ב-4 מעלות צלזיוס עם הנוגדנים העיקריים (1:300 anti-Oct3/4 (BD Biosciences, מספר קטלוגי 611202)) ב-2% BSA/PBS. לאחר שטיפת הדגימות שלוש פעמים עם PBS, נוספו נוגדנים משניים (1:200 Alexa Fluor 488, 1:200 Phalloidin ATTO 550 ו-1:1,000 Hoechst 33342) ב-2% BSA/PBS והודגרו למשך הלילה ב-4°C. תמונות קונפוקאליות נרכשו באמצעות מיקרוסקופ קונפוקאלי של Opera Phenix Plus (PerkinElmer).
באשר ל-hTSCs ואורגנואידים trophoblast, הדגימות תוקנו עם 2% פרפורמלדהיד למשך 40 דקות ב-4 מעלות צלזיוס, עברו חלחול עם 0.5% Tween-20/PBS למשך 30 דקות ונחסמו עם 3% BSA (Sigma) 0.1%+ 20. למשך שעה אחת. התאים הודגרו עם הנוגדנים העיקריים בתמיסת החסימה למשך יומיים ב-1 מעלות צלזיוס. הנוגדנים העיקריים בהם נעשה שימוש היו: אנטי-E-cadherin (Invitrogen, מספר קטלוגי 2-4, 13:1900), אנטי-סינדקן (Sigma, מספר קטלוגי HPA1, 200:006185), אנטי-GATA1 (מו"פ, מספר קטלוגי AF200, 3:2605), אנטי-ENDOU (Sigma, מספר קטלוגי HPA1, 200:012388), אנטי-GCM1 (אטלס, מספר קטלוגי HPA200, 1:011343) ואנטי-TEAD1 (abcam, מספר קטלוגי ab200, 4:58310). לאחר שטיפה עם PBS 1 פעמים, התאים הודגרו עם הנוגדנים המשניים בתמיסת החסימה למשך יומיים ב-200 מעלות צלזיוס. הנוגדנים המשניים בהם השתמשו היו: נוגדנים מצומדים Alexa Fluor 3-, 2- ו-4. גרעינים נצבעו בהוכסט (488:594). תמונות קונפוקאליות נרכשו באמצעות מיקרוסקופ הפוך של Zeiss LSM 647 והמטרה ×1/200 LCI Plan-Neofluar עם מדיום טבילה במים.
אמירה אתית
הסכמה מדעת התקבלה מכל הנמענים ו/או התורמים של תאים או רקמות. המחקר שכלל דם מלא אנושי כוסה בהצבעה האתית EK-BR-24/18-1 של Sächsische Landesärztekammer. הדם התקבל משני תורמים מרצון התואמים ABO שלא השתמשו בשום תרופה בעשרת הימים האחרונים. המחקר שכלל MSCs שמקורם במח עצם אנושי כוסה בהצבעה האתית EK221102004 ו-EK47022007 ב-TU Dresden. MSCs בודדו מתורמות בריאות ותורמות (בני 26-37) על ידי הפקולטה לרפואה בבית החולים האוניברסיטאי בדרזדן. המחקר שכלל HiPSCs היה מכוסה בהצבעה האתית EK363112012 ב-TU Dresden. hiPSCs נוצרו מתאי CD34+ ממיון MACS מדם היקפי של תורם בריא (בני 20-24). קו תאי גזע trophoblast שמקורו במטופלים CT27, ששימשו במחקר זה, נגזר מתאי ציטוטרופובלסט שליה והושג מבנק תאי הגזע RIKEN (RCB4936:CT27). שליות אנושיות התקבלו מנשים בריאות עם הסכמה מדעת חתומה של התורמים, ואישור ועדת האתיקה של בית הספר לרפואה של אוניברסיטת טוהוקו (רישיון מחקר 2014-1-879).
סטטיסטיקה ושחזור
גרפים וניתוחים סטטיסטיים בוצעו ב-GraphPad Prism and Origin 2022. גדלי המדגם מפורטים בכתוביות האיור, שם n מתייחס למספר הדגימות הנבדלות. עבור בדיקת כדאיות התא, בוצעה מבחן חד כיווני של שונות (ANOVA) עם בדיקת Tukey post-hoc (n = 3, df = 4). עבור בדיקות תאימות הדם, בוצעה ANOVA חד כיוונית עם בדיקת Holm-Sidak post-hoc (n = 3, df = 6). הנתונים מבוטאים כממוצע ± s.d., עם *P < = 0.05, **P < = 0.01 ו-***P < = 0.001 המצביע על מובהקות סטטיסטית. לא נעשה שימוש בשיטה סטטיסטית לקביעת גודל המדגם, ולא נכללו נתונים מהניתוחים. הניסויים לא היו אקראי, והחוקרים לא היו עיוורים להקצאה במהלך הניסויים והערכת התוצאות.
סיכום הדיווח
מידע נוסף על עיצוב המחקר זמין ב סיכום דיווח תיקי טבע מקושר למאמר זה.
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. רכב / רכבים חשמליים, פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- BlockOffsets. מודרניזציה של בעלות על קיזוז סביבתי. גישה כאן.
- מקור: https://www.nature.com/articles/s41565-023-01483-3
- :הוא
- :לֹא
- :איפה
- ][עמ'
- 000
- 1
- 10
- 100
- 12
- 14
- 15%
- 19
- 1998
- 1999
- 2%
- 20
- 200
- 2012
- 2018
- 2020
- 2022
- 22
- 24
- 26
- 27
- 30
- 300
- 320
- 33
- 36
- 3d
- 40
- 50
- 500
- 60
- 65
- 66
- 67
- 7
- 70
- 75
- 8
- 80
- 9
- 95%
- a
- מֵעַל
- פי
- להשיג
- נרכש
- מופעל
- מפעילה
- הפעלה
- פעילות
- הוסיף
- תוספים
- לאחר
- נגד
- זקן
- AIR
- AL
- Alexa
- תעשיות
- הַקצָאָה
- מותר
- מאפשר
- am
- an
- אנליזה
- עוגן
- ו
- נוגדנים
- כל
- יישומית
- הסכמה
- ARE
- AREA
- סביב
- מאמר
- AS
- הערכה
- להניח
- At
- אטלס
- מְצוֹרָף
- זמין
- הימנעות
- b
- בנק
- מבוסס
- BD
- BE
- היה
- לפני
- בֵּין
- לאגד
- כריכה
- ביולוגיה
- חומרים ביולוגיים
- שחור
- חסום
- חסימה
- דם
- לוּחַ
- עֶצֶם
- ארגון ה-BSA
- חיץ
- by
- מחושב
- CAN
- כיתובים
- נתפס
- מובילים
- לשאת
- תא
- תאים
- שרשראות
- מאפיינים
- כימי
- ניקוי
- קליק
- מסחרי
- הוועדה
- השוואה
- תאימות
- השלמה
- משלימה
- מורכב
- רכיבים
- מרוכז
- ריכוז
- מצב
- תנאים
- מנוהל
- הסכמה
- נחשב
- קבוע
- תוכן
- לִשְׁלוֹט
- המרה
- תוֹאֵם
- ספירה
- מכוסה
- נוצר
- תַרְבּוּת
- מנהג
- מחזורי
- כהה
- נתונים
- ימים
- מת
- צפיפות
- נגזרים
- נגזר
- מְתוּאָר
- עיצוב
- מְפוֹרָט
- לקבוע
- נחוש
- מפותח
- מובהק
- הפצה
- ה-DNA
- תחומים
- תורמים
- שפיר
- בְּמַהֲלָך
- דינמי
- e
- E&T
- כל אחד
- מוטבע
- הנדסה
- אַנְגלִיָה
- לְהַבטִיחַ
- שווה
- Ether (ETH)
- אתי
- אתיקה
- EU
- הערכה
- כל
- דוגמה
- נשלל
- צפוי
- ניסויים
- חשוף
- חשיפה
- ביטא
- ביטוי
- מקל
- מתקן
- גורם
- נְקֵבָה
- תאנה
- תרשים
- ממולא
- סרטים
- סופי
- בסופו של דבר
- ראשון
- קבוע
- תזרים
- בעקבות
- הבא
- בעד
- התהוות
- קדימה
- חופשי
- תדר
- החל מ-
- גז
- נוצר
- גנרטור
- גאומטריה
- זכוכית
- זהב
- ציון
- הדרגתית
- קְבוּצָה
- קבוצה
- היה
- בריא
- גובה
- הוחזק
- גָבוֹהַ
- מאוד
- מחזיק
- בית חולים
- שעה
- HTTPS
- בן אנוש
- i
- ID
- זהה
- מזוהה
- ii
- תמונות
- מיד
- שָׁקוּעַ
- טְבִילָה
- פְּגִיעָה
- in
- כלול
- דגירה
- דגירה
- המציין
- בנפרד
- מידע
- הודעה
- בתחילה
- ליזום
- יזם
- מוסיף
- התקנה
- מיידי
- מכשיר
- מכשירים
- משולב
- מִמְשָׁק
- אל תוך
- חוקרים
- מעורב
- מעורב
- איווה
- מְבוּדָד
- IT
- שֶׁלָה
- שמר
- שכבה
- סִפְרִיָה
- רישיון
- אוֹר
- להגביל
- קו
- קשר
- צמוד
- לחיות
- ארוך
- להוריד
- עשוי
- לתחזק
- חוֹמֶר
- אומר
- נמדד
- מדידה
- מידות
- רפואי
- רפואה
- בינוני
- מתנול
- שיטה
- שיטות
- מיקרוסקופ
- דקות
- מינימום
- מעורב
- תַעֲרוֹבֶת
- ML
- מודל
- שונים
- מולקולרי
- שם
- ננוטכנולוגיה
- צר
- טבע
- הכרחי
- חדש
- לא
- הערות
- רומן
- מספר
- מספרים
- מטרה
- מושג
- of
- on
- ONE
- רק
- עַל גַבֵּי
- Opera
- or
- רגיל
- מָקוֹר
- אַחֶרֶת
- שלנו
- הַחוּצָה
- תוֹצָאָה
- יותר
- בין לילה
- אוקספורד
- חמצן
- זוג
- זוגות
- מאמר
- מקביל
- פרמטרים
- שותפים
- עבר
- עבר
- PBS
- PCR
- עבור
- ביצעתי
- שולי
- פלזמה
- פלטפורמה
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- ועוד
- פולימר
- בריכה
- תיק עבודות
- חיובי
- חִיוּבִיוּת
- אפשרי
- הודעה
- צורך
- מבשר
- בעיקר
- הכנה
- מוּכָן
- נוכחות
- למנוע
- יְסוֹדִי
- הדפסה
- PROC
- תהליך
- תָכְנִית
- תָקִין
- נכסים
- מוּגָן
- חֶלְבּוֹן
- פרוטוקול
- ובלבד
- נרכש
- פיתון
- כמותי
- מהירות
- R
- R & D
- ארנב
- רמפה
- אקראי
- רכס
- ציון
- יחס
- לְהַגִיעַ
- תגובה
- תגובות
- זמן אמת
- מציאות
- קיבלו
- נמענים
- מוּמלָץ
- מוקלט
- הקלטה
- מופחת
- הפניה
- מתייחס
- רשום
- קרוב משפחה
- לשחרר
- להסיר
- חזר
- דווח
- מחקר
- וכתוצאה מכך
- להפוך
- RIKEN
- חֶדֶר
- s
- בית ספר
- SCI
- מדעי
- שְׁנִיָה
- משני
- סֶלֶקטִיבִי
- רצף
- סט
- הצבה
- סימנס
- סיגמא
- אותות
- חָתוּם
- משמעות
- באופן משמעותי
- משי
- פשוט
- מידה
- גדל
- להחליק
- לאט
- קטן
- חכם
- נתרן
- תוכנה
- מוצק
- פִּתָרוֹן
- פתרונות
- פותר
- מקורות
- ספציפי
- מפורט
- ספקטרוסקופיה
- מְהִירוּת
- נקודות
- סטטיסטי
- גֶזַע
- תאי גזע
- צעדים
- מאוחסן
- קווצות
- לחץ
- לימוד
- כתוצאה מכך
- שסופק
- משטח
- הַשׁעָיָה
- מערכת
- מערכות
- T
- שולחן
- משימות
- מטרות
- טכנולוגיות
- עשר
- מבחן
- בדיקות
- זֶה
- השמיים
- שֶׁלָהֶם
- אז
- תיאורטי
- לכן
- תרמי
- הֵם
- זֶה
- שְׁלוֹשָׁה
- סף
- דרך
- זמן
- פִּי
- רקמות
- ל
- כלי
- סה"כ
- הועבר
- להפעיל
- טריטון
- שתיים
- תחת
- מאוחד
- אוניברסיטה
- מְיוּתָר
- ארה"ב
- מְשׁוּמָשׁ
- באמצעות
- ערכים
- גִרְסָה אַחֶרֶת
- לאמת
- רב צדדי
- גרסה
- באמצעות
- יכולת חיוניות הקיום
- לצפיה
- כֶּרֶך
- כרכים
- מִרָצוֹן
- הַצבָּעָה
- היה
- כביסה
- מים
- we
- מִשׁקָל
- טוֹב
- היו
- מתי
- אשר
- בזמן
- מי
- כל
- עם
- בתוך
- נשים
- היה
- X
- תְשׁוּאָה
- תשואות
- זפירנט