主な発明者
Advantages
- 構成要素としての DNA
- 幅広いアプリケーション
- 大きな可能性を秘めた低コスト

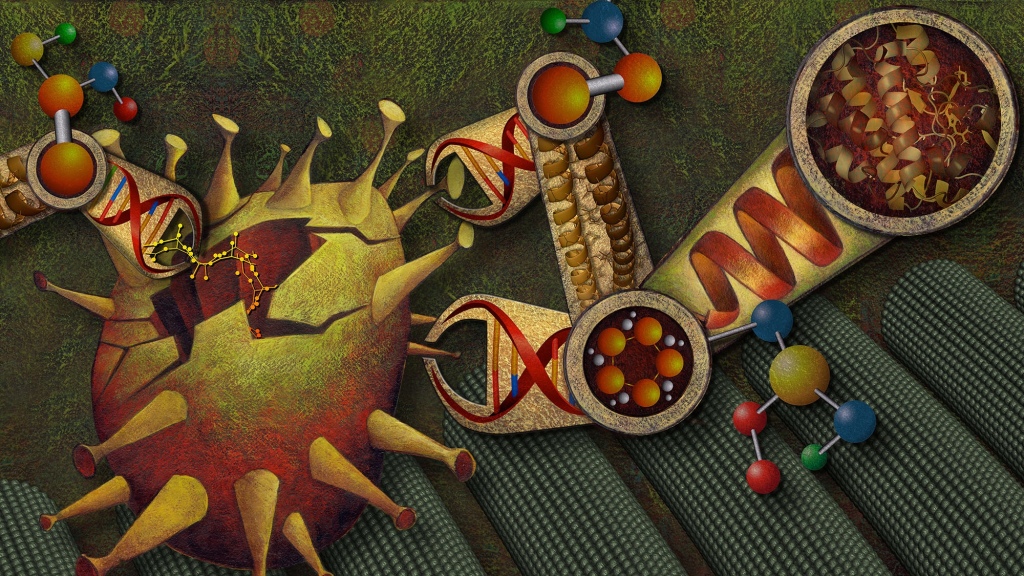
細胞および組織の透過性、生体適合性、およびナノスケール レベルでの高いプログラム可能性を備えた DNA ナノ構造は、新しいタイプのドラッグ デリバリー ビヒクル、特異性の高い診断デバイス、および生体分子がどのように動的に形状を変化させ、相互作用するかを解読するツールとして有望な候補です。お互いに、候補薬と。 ウィス研究所の研究者は、幅広い臨床および生物医学研究分野に独自の機能と可能性を備えた、多様で多機能な一連の DNA ナノテクノロジー ツールを提供しています。
治療薬送達のための DNA ナノテクノロジー デバイス
DNA ナノ構造は、薬物や免疫増強抗原、人体の標的細胞や組織へのアジュバントなど、さまざまな生物学的に活性な分子を輸送および提示するために広く使用される将来の可能性を秘めています。
がんワクチンの高精度送達コンポーネントとしての DNA 折り紙
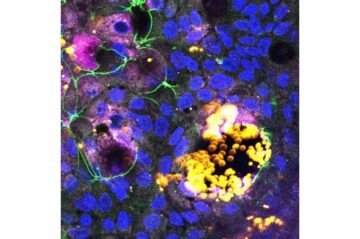
ウィス研究所が開発した がんワクチン 免疫療法を改善します。 これらのアプローチは、腫瘍特異的抗原を提示する埋め込み型または注射型の生体材料ベースの足場と、樹状免疫細胞 (DC) を足場に引き付ける生体分子を使用し、それらを活性化して、それらの放出後に腫瘍に対する抗腫瘍 T 細胞応答を調整できるようにします。同じ抗原を持っています。 DC が最も効果的に活性化されるためには、細胞表面の受容体分子の密度と分布と一致する特定の比率 (化学量論) と構成で、腫瘍抗原と免疫を高める CpG アジュバント分子を経験する必要があると考えられます。
特別に開発された 剛体の正方格子ブロックに組み立てるようにプログラムされた DNA 折り紙 ナノスケールの精度で生体材料足場内のDCに腫瘍抗原とアジュバントを共存させることは、治療用癌ワクチンの有効性を高める可能性があり、抗癌剤でさらに機能化することができます。
薬物送達 DNA ナノ構造を保護するための化学修飾戦略
自己組織化 DNA オリガミなどの DNA ナノ構造は、医薬品や診断薬の提供に有望な媒体です。 それらは、特定の標的細胞や組織への送達を容易にする機能だけでなく、低分子薬やタンパク質薬で柔軟に官能化することができます。 しかし、体の組織や血液中での安定性が限られているため、その可能性は妨げられています。 DNA ナノ構造の驚異的な可能性を実現するために、Wyss の研究者は 簡単で効果的かつスケーラブルな化学架橋アプローチ DNAナノ構造に、医薬品や診断の効果的な媒体として必要な安定性を提供できます。
費用対効果の高い XNUMX つの簡単な手順である Wyss のアプローチでは、最初に 低分子で目立たない中和剤、DNA折り紙構造をカバーするために、複数の正電荷を運ぶPEG-オリゴリジン。 一般的に使用されるMgとは対照的に2+それぞれが DNA 構造の 400 つの負の変化のみを中和しますが、PEG-オリゴリジンは複数の負電荷を XNUMX つでカバーし、安定した「静電ネット」を形成し、DNA ナノ構造の安定性を約 XNUMX 倍に高めます。 次に、 化学架橋 グルタルアルデヒドとして知られる試薬により、追加の安定化結合が静電網に導入され、DNA ナノ構造の安定性がさらに 250 倍増加し、幅広い臨床応用に適合する範囲に半減期が延長されます。
超高感度診断および分析ツールとしての DNA ナノテクノロジー デバイス
疾患または病原体に特異的な核酸に応答して検出可能な DNA ナノ構造を生成することは、原則として、多様なサンプルで非常に効果的なバイオマーカー検出の手段を提供します。 合成オリゴヌクレオチドの標的核酸への単一分子結合イベントは、DNA タイルやブリックのような小さな合成 DNA ユニットが協同的に組み立てられてより大きな構造になることにより、はるかに大きな構造の作成の核となり、簡単な実験室アッセイで視覚化することができます。 ただし、これらのアプローチの中心的な障害は、偽陽性の結果につながる可能性がある特定の標的核酸の非存在下での (1) 非特異的結合および (2) 非特異的核形成イベントの発生です。 Wyss DNA ナノテクノロジー研究者は、これらの問題に対して、別々に適用できるが組み合わせ可能な XNUMX つのソリューションを開発しました。
DNAナノスイッチカテナンによるバイオマーカー分子のデジタルカウンティング
超高感度と特異性を備えたバイオマーカーの初期検出 (結合) を可能にするために、Wyss の研究者は、より大きなカテナン (ラテン語) として設計されたタイプの DNA ナノスイッチを開発しました。 チェーン鎖を意味する)は、単一のバイオマーカー分子の検出と計数を可能にする特定の機能を備えた機械的に連結されたリング状の部分構造から組み立てられています。 「DNA ナノスイッチ カテナン」構造では、より長い合成 DNA 鎖の両端が XNUMX つの抗体フラグメントに結合されており、それぞれが対象の同じバイオマーカー分子の異なる部分に特異的に結合するため、高い標的特異性と感度が可能になります。
このブリッジング イベントにより、ストランドは「ホスト リング」に近づき、さまざまな「ゲスト リング」を持つさまざまな領域でインターロックされます。 ホスト リングを閉じると、ゲスト リングが新しい DNA 鎖の合成を可能にする構成に切り替わります。 新しく合成された診断鎖は、単一のデジタル分子カウントとして明確に検出できますが、抗体フラグメント/バイオマーカー複合体を破壊すると、新しいバイオマーカーカウントサイクルが開始されます。 標的結合特異性と標的特異的 DNA 鎖の合成の両方により、複数の DNA ナノスイッチ カテナンを組み合わせて、単一の多重化反応で異なるバイオマーカー分子を同時にカウントすることもできます。
超高感度の診断では、増幅速度が最も速く、スプリアス核生成の速度が最も低いことが望ましいです。 DNA ナノテクノロジーのアプローチは、これを酵素を使わずに低コストで提供できる可能性を秘めています。
ウィリアム・シー
多様なバイオマーカーの迅速な増幅プラットフォーム
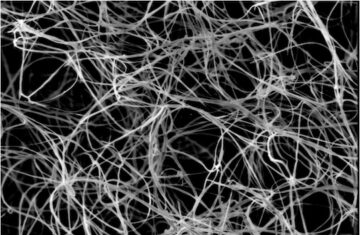
A 迅速、低コスト、酵素フリーの検出および増幅プラットフォーム 非特異的な核形成と増幅を回避し、わずか数分で単一のシードからはるかに大きなミクロン スケールの構造の自己組織化を可能にします。 「」と呼ばれる方法十字型ナノシード検出」は、単一のバイオマーカー結合イベントから始まるリボンの超協調的なアセンブリを可能にします。 ミクロン スケールの構造は、一本鎖の「DNA スラット」から密に織り込まれています。これにより、インバウンド スラットは、成長しているリボンの端にある 15 つ以上の以前に捕捉されたスラットの上と下を「十字」に蛇行し、弱いが非常に特異的な相互作用を形成します。その相互作用する DNA スラットを使用します。 アセンブリ プロセスの核形成は、厳密にターゲット シード固有であり、アセンブリは、さらに試薬を追加することなく、広い温度範囲にわたって約 XNUMX 分で XNUMX ステップの反応で実行できます。 次に、標準的な実験装置を使用して、組み立てられた構造を迅速に視覚化するか、たとえばハイスループット蛍光プレート リーダー アッセイを使用して検出することができます。

現在の機会 – スタートアップ
クリスクロス ナノシード検出: ナノテクノロジーを活用した感染症診断
ポイントオブケア設定で幅広いアクセスを可能にする、感染症バイオマーカーの迅速、超高感度、低コスト検出のための酵素を使用しない DNA ナノテクノロジー。
クリスクロス ナノシード検出法における DNA アセンブリ プロセスは、分子記録の保存につながるバイオマーカー分子を特異的に検出する DNA ナノスイッチ カテナンの作用にも関連付けることができます。 生き残った各記録は、十字型ナノ構造のアセンブリの核となり、高特異性結合とバイオマーカー検出のための増幅を組み合わせます。
Wyss の研究者は現在、SARS-CoV-19 ウイルスやその他の病原体を引き起こす COVID-2 の多重化可能な低コスト診断として、現在使用されている手法よりも迅速かつ低コストで正確な結果を得ることができるアプローチを開発しています。
単一分子レベルでタンパク質の構造と同一性を決定するためのナノスケール デバイス
微量の生物学的サンプルからタンパク質を特定して定量化する能力は、個々の細胞内のタンパク質発現の変化を監視することから、疾患の新しいバイオマーカーの発見を可能にすることまで、基礎研究と臨床診療の両方に大きな影響を与えるでしょう. さらに、それらの構造と相互作用も決定する能力は、創薬と特性評価のための新しい道を開くでしょう。 過去数十年にわたり、DNA 分析とシーケンシングの発展は疑いの余地なく医学に革命をもたらしましたが、タンパク質分析の同等の発展は依然として課題のままでした。 タンパク質同定のための質量分析や構造決定のためのクライオ EM などの方法は急速に進歩しましたが、解像度と微量の異種サンプルを扱う能力に関しては課題が残っています。
この課題に対処するために、Wyss Institute の研究者は、DNA ナノテクノロジーと単一分子操作を組み合わせて、タンパク質やその他の高分子の構造同定と分析を可能にする新しいアプローチを開発しました。 「DNA ナノスイッチ キャリパー」(DNC) は、距離を測定し、溶液中の単一タンパク質内の形状を決定することにより、「指紋タンパク質」に対する高解像度のアプローチを提供します。 DNC は、目的の標的分子に取り付けられた DNA ハンドル間の距離を測定するように設計されたナノデバイスです。 DNC の状態は、以下を使用して作動および読み取ることができます。 単分子力分光法、各単一分子に対して複数の絶対距離測定を可能にします。
DNC は、構造生物学、プロテオミクス、診断、創薬など、さまざまな分野の研究を進めるために広く適応させることができます。
すべてのテクノロジーは開発中であり、業界のコラボレーションに利用できます。
.wordads-ad-wrapper { 表示: なし; フォント: 通常の 11px Arial、サンセリフ。 文字間隔: 1px; テキスト装飾: なし; 幅: 100%; マージン: 25px 自動; パディング: 0; } .wordads-ad-title { margin-bottom: 5px; } .wordads-ad-controls { マージントップ: 5px; テキスト整列: 右; } .wordads-ad-controls スパン { カーソル: ポインター; } .wordads-ad { width: fit-content; マージン: 0 自動; }
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- Platoblockchain。 Web3メタバースインテリジェンス。 知識の増幅。 こちらからアクセスしてください。
- 情報源: https://genesisnanotech.wordpress.com/2023/01/16/dna-nanotechnology-tools-from-design-to-applications-current-opportunities-and-collaborations-wyss-institute-harvard-university/
- 1
- 11
- a
- 能力
- 私たちについて
- 絶対の
- 接近性
- 正確な
- Action
- アクティブ
- 適合しました
- 添加
- NEW
- 進める
- 高度な
- 後
- に対して
- 許可
- ことができます
- 分析
- 分析的
- および
- 別の
- 適用可能な
- 適用
- アプローチ
- アプローチ
- エリア
- 組み立て
- アセンブリ
- オート
- 利用できます
- 基本
- の間に
- ビッグ
- バインド
- 拘束
- 生物学
- バイオマーカー
- 生物医学
- 血
- ボディ
- 絆
- ブースト
- 広い
- 建物
- 呼ばれます
- 癌
- 候補者
- 候補
- 機能
- 携帯
- 原因
- 原因
- 細胞
- 中央の
- チェーン
- 挑戦する
- 課題
- 変化する
- 変更
- 課金
- 化学物質
- 臨床
- 閉じる
- 閉鎖
- コラボレーション
- 組み合わせ
- 組み合わせ
- 結合
- 一般に
- 互換性のあります
- 複雑な
- コンポーネント
- コントラスト
- 協同組合
- 費用
- コスト効率の良い
- コスト
- 可能性
- カバー
- カバー
- コロナ
- CPG
- 創造
- 電流プローブ
- 現在
- 数十年
- 解読
- 配信する
- 配達
- 設計
- 設計
- 検出された
- 検出
- 決定
- 決定する
- 決定
- 発展した
- 開発
- 開発
- 進展
- Devices
- 異なります
- デジタル
- 発見
- 病気
- ディスプレイ
- 距離
- ディストリビューション
- 異なる
- DNA
- 薬
- 創薬
- 薬物
- 各
- 効果的な
- 効果的に
- enable
- 可能
- 有効にする
- 終了
- 装置
- 同等の
- イベント
- イベント
- 例
- 体験
- 延伸
- 異常な
- 容易にする
- 速いです
- 最速
- 特徴
- 名
- 強
- から
- 満たす
- 機能性
- さらに
- さらに
- 未来
- 世代
- 与える
- 成長
- ゲスト
- ハンドル
- ハーバード
- ハーバード大学
- 助けます
- ハイ
- 高解像度の
- 非常に
- host
- 認定条件
- しかしながら
- HTTPS
- 人間
- 識別
- 識別する
- アイデンティティ
- 影響
- 改善します
- in
- 含めて
- 増加
- 個人
- 産業を変えます
- 初期
- 機関
- 対話
- 相互作用
- 相互作用
- 関心
- 導入
- IT
- 既知の
- 実験室
- より大きい
- ラテン
- つながる
- 主要な
- レベル
- 可能性が高い
- 限定的
- リンク
- より長いです
- 製
- 操作
- 方法
- マージン
- 質量
- 最大幅
- 手段
- だけど
- 測定結果
- 計測
- 薬
- 大会
- 方法
- メソッド
- 分
- 分子の
- 分子
- モニタリング
- 他には?
- 最も
- の試合に
- ナノテクノロジー
- 自然
- 必要
- 負
- net
- 新作
- 通常の
- 障害
- 提供
- オファー
- ONE
- 開いた
- 機会
- 機会
- その他
- さもないと
- 克服する
- 特定の
- 部品
- 過去
- プラットフォーム
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 正の
- 潜在的な
- 練習
- 精度
- 現在
- 前に
- 原則
- 問題
- プロセス
- プログラム
- 約束
- 有望
- 守る
- タンパク質
- タンパク質
- 提供します
- 提供
- 範囲
- 急速な
- 急速に
- レート
- 反応
- 読む
- リーダー
- 記録
- に対する
- 地域
- 登録
- リリース
- 残る
- 残った
- 研究
- 研究者
- 解像度
- 応答
- 結果
- 革命を起こした
- リボン
- 堅い
- リング
- 同じ
- SARS-CoVの-2
- ド電源のデ
- シード
- 感度
- 設定
- シェイプ
- 簡単な拡張で
- 同時に
- SIX
- 小さい
- より小さい
- So
- 溶液
- ソリューション
- 特定の
- 特に
- 特異性
- 安定性
- 安定した
- 標準
- 起動
- 開始
- 米国
- ステップ
- 戦略
- 構造の
- 構造
- そのような
- スイート
- 表面
- 合成
- ターゲット
- テクニック
- テクノロジー
- アプリ環境に合わせて
- 治療の
- 組織
- 〜へ
- 一緒に
- 豊富なツール群
- トレース
- 輸送
- 下
- 理解する
- ユニーク
- ユニット
- 大学
- つかいます
- ワクチン
- 多様
- 車
- ウイルス
- which
- while
- 広く
- 以内
- 無し
- WordPress
- 仕事
- でしょう
- ゼファーネット