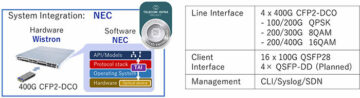
マサチューセッツ州ケンブリッジ、28 年 2022 月 4 日 – (JCN Newswire) – バイオジェン株式会社とエーザイ株式会社(東京、日本)は本日、ADUHELM(アデュカヌマブavwa) 早期アルツハイマー病における静脈内使用のための 100 mg/mL 注射。多様な登録と主要評価項目に関する研究の目標の詳細が含まれます。
Biogenは、米国の参加者の18%を黒人/アフリカ系アメリカ人およびラテン系の人々からENVISIONに登録することを目指しています。 この目標は、臨床試験の多様性を高めるというバイオジェンの継続的な取り組みを反映しています。
「歴史的に、さまざまなバックグラウンドを持つ患者はアルツハイマー病の臨床試験で十分に代表されていませんでした。私たちはこれを変えることに取り組んでいます」と、Biogenのグローバル安全規制科学責任者および暫定研究開発責任者であるPriya Singhal MD、MPHは述べています。 「この目標は、初期のアルツハイマー病と診断されたアメリカ人の多様性と一致しますが、同時に、この試験は、ADUHELMの有効性を検証するための実質的なデータを生成します。」
Biogenは、医療センターへのアクセスの欠如、治療のベネフィット/リスクプロファイルに精通していること、財政的またはロジスティックな負担など、アルツハイマー病の試験への多様な患者登録の障壁を克服するのに役立つ複数の戦略を実装します。
「登録時に優先され、ENVISION臨床試験の重要な部分として統合される多様性へのこの野心的な焦点を確認することが重要です。これにより、クリニックで見られるものをより厳密に表す患者からのデータを取得できます」とDylanWint氏は述べています。 MD、クリーブランドクリニックLou Ruvo Center for Brain Health、ネバダ州。
両社は本日、グローバルなプラセボ対照ENVISION試験の主要評価項目が、ADUHELMによる治療開始から18か月後のボックスの臨床認知症評価合計(CDR-SB)によって測定されることを発表しました。 CDR-SBエンドポイントは、認知と機能の両方の検証済みの指標であり、初期の症候性アルツハイマー病患者の臨床試験で広く使用されており、ADUHELMの第3相EMERGEおよびENGAGE試験と一致しており、強力な結果を生み出すことができます。 このアップデートには、以前に発表された登録者数の増加が含まれ、アミロイドベータ病理の確認とともに、初期アルツハイマー病(アルツハイマー病および軽度アルツハイマー病による軽度認知障害)の1,300人から1,500人に増加し、勉強。
ENVISIONおよびその他のADUHELM臨床試験はすでに計画または進行中ですが、メディケアおよびメディケイドサービスセンター(CMS)は最近、ADUHELMおよびその他のアミロイド標的療法のメディケア適用範囲を登録患者に制限する全国適用範囲決定(NCD)草案を発表しました。追加の臨床試験で。 Biogenは、臨床試験の不必要な重複を回避するためにCMSと連携し、2003年以来最初のFDA承認のアルツハイマー病治療への患者への即時アクセスを提供するための道を見つけることに取り組んでいます。
主要評価項目である CDR-SB に加え、副次評価項目には、アルツハイマー病評価スケール - 認知サブスケール (ADAS-Cog 13)、アルツハイマー病共同研究 - 日常生活活動のインベントリ - 軽度認知障害バージョン (ADCS-ADL-MCI) が含まれます。 、統合アルツハイマー病評価スケール (iADRS)、ミニ精神状態検査 (MMSE)、および精神神経検査 (NPI-10)。
ENVISIONの患者スクリーニングの開始は、2022年3月に予定されています。ADUHELMによる以前の第XNUMX相試験の登録率に基づくと、主要な完了日は、試験開始後約XNUMX年と予想されます。 両社は、この試験に参加する医療専門家、医療センター、患者、家族に感謝しています。
以前は、2021年4月(新しいウィンドウ)に、企業は、合計約6,000人の患者を登録することを目的とした観察フェーズXNUMX ICAREAD試験で別の実質的な多様性目標を設定しました。
ADUHELM(aducanumab-avwa)について静脈内使用のための100mg / mL注射
ADUHELMはアルツハイマー病の治療に適応されています。 ADUHELMによる治療は、軽度の認知障害または軽度の認知症の病期の患者、つまり臨床試験で治療が開始された集団で開始する必要があります。 研究されたよりも病気の初期または後期に治療を開始することに関する安全性または有効性のデータはありません。 この適応症は、ADUHELMで治療された患者で観察されたアミロイドベータプラークの減少に基づく迅速承認の下で承認されています。 この適応症の継続的な承認は、確認試験における臨床的利益の検証を条件とする場合があります。
ADUHELMは、アミロイドベータに対するモノクローナル抗体です。 脳内のアミロイドベータプラークの蓄積は、アルツハイマー病の明確な病態生理学的特徴です。 ADUHELMの迅速承認は、臨床的利益、この場合は臨床的衰退の減少を合理的に予測する可能性が高い代理バイオマーカーであるアミロイドベータプラークの減少に対するADUHELMの効果を示す臨床試験のデータに基づいて付与されました。
ADUHELMは、アミロイド関連画像異常または「ARIA」を含む深刻な副作用を引き起こす可能性があります。 ARIAは一般的な副作用であり、通常は症状を引き起こしませんが、深刻な場合があります。 ほとんどの人には症状がありませんが、頭痛、錯乱、めまい、視力の変化、吐き気などの症状がある人もいます。 患者の医療提供者は、ARIAをチェックするために、ADUHELMによる治療前および治療中に磁気共鳴画像法(MRI)スキャンを行います。 アデュカヌマブはまた、深刻なアレルギー反応を引き起こす可能性があります。 ADUHELMの最も一般的な副作用には、次のようなものがあります。脳または脳の表面(ARIA)に小さな出血斑がある場合とない場合の、脳の領域の腫れ。 頭痛; そして落ちる。 患者は、副作用に関する医学的アドバイスについて医療提供者に電話する必要があります。
2017年XNUMX月現在、バイオジェンとエーザイ株式会社は、アデュカヌマブのグローバルな共同開発と共同プロモーションに協力しています。
バイオジェンについて
神経科学のパイオニアとして、Biogenは、深刻な神経疾患および関連する治療的隣接を抱える人々のために、世界的に革新的な治療法を発見、開発、提供しています。 世界初のグローバルバイオテクノロジー企業の1978つであるバイオジェンは、XNUMX年にチャールズワイスマン、ハインツシャーラー、ケネスマレー卿、ノーベル賞受賞者のウォルターギルバートとフィリップシャープによって設立されました。 今日、Biogenは多発性硬化症を治療するための主要な医薬品ポートフォリオを持ち、脊髄性筋萎縮症の最初の承認された治療法を導入し、アルツハイマー病の明確な病状に対処するための最初で唯一の承認された治療法を提供しています。 バイオジェンはまた、バイオシミラーを商品化し、満たされていないニーズの高いいくつかの分野の患者の標準治療を変革する、神経科学における業界で最も多様なパイプラインの進歩に焦点を合わせています。
2020年、Biogenは、気候、健康、公平性の深く相互に関連する問題に対処するために、大胆な20年間の250億XNUMX万ドルのイニシアチブを開始しました。 健康的な気候、健康的な生活は、会社の事業全体で化石燃料を排除し、有名な機関とのコラボレーションを構築して科学を進歩させ、人間の健康の結果を改善し、サービスの行き届いていないコミュニティをサポートすることを目的としています。
エーザイ株式会社について
エーザイ株式会社は、日本に本社を置く世界有数の製薬会社です。 エーザイの企業理念は、患者さんとそのご家族を第一に考え、医療のメリットを高めるというヒューマンヘルスケア(hhc)の考え方に基づいています。 研究開発施設、製造拠点、マーケティング子会社のグローバルネットワークにより、神経学と腫瘍学の戦略的分野に特に重点を置いて、満たされていない医療ニーズの高い疾患を対象とした革新的な製品を提供することにより、hhc哲学の実現に努めています。
エーザイは、アルツハイマー病治療薬の開発・販売で得た経験を活かし、「エーザイ認知症プラットフォーム」の確立を目指しています。 このプラットフォームを通じて、エーザイは、民間だけでなく、医療機関、診断開発会社、研究機関、バイオベンチャーなどのパートナーと協力して、「認知症エコシステム」を構築することで、認知症の人とその家族に新たなメリットを提供する予定です。保険代理店、金融業界、フィットネスクラブ、自動車メーカー、小売業者、介護施設。 エーザイ株式会社の詳細については、以下をご覧ください。 https://www.eisai.com.
メディアの連絡先
バイオジェン株式会社
アシュリーコス
+ 1-908-205-2572
public.affairs@biogen.com
エーザイ株式会社(米国メディア)
広報部
+1-201-753-1945
エーザイ株式会社(米国外メディア)
広報部
TEL: +81-(0)3-3817-5120
バイオジェンセーフハーバー
このニュースリリースには、ADUHELMの潜在的な臨床効果について、1995年の民事証券訴訟改革法のセーフハーバー条項に従って行われた声明を含む、将来の見通しに関する声明が含まれています。 ADUHELMの潜在的な利点、安全性、有効性。 ENVISIONの結果。 アルツハイマー病の治療; エーザイとのバイオジェンのコラボレーション契約の予想されるメリットと可能性。 臨床開発プログラム、臨床試験、データの読み出しとプレゼンテーション。 医薬品の開発と商品化に関連するリスクと不確実性。 これらの記述は、「目指す」、「期待する」、「信じる」、「できた」、「推定する」、「期待する」、「予測する」、「意図する」、「かもしれない」、「計画する」、「可能」、「可能性」、「意志」、「意志」、および同様の意味の他の単語や用語。 医薬品の開発と商品化には高いリスクが伴い、製品の商品化につながる研究開発プログラムはごくわずかです。 初期段階の臨床試験の結果は、完全な結果または後期段階または大規模な臨床試験の結果を示すものではなく、規制当局の承認を保証するものではありません。 これらの記述または提示された科学的データに過度の信頼を置くべきではありません。
これらの記述には、実際の結果がそのような記述に反映されているものと大きく異なる可能性のあるリスクと不確実性が含まれます。これには、追加のデータ、分析、または臨床試験中に得られた結果から生じる可能性のある予期しない懸念が含まれますが、これらに限定されません。 安全上の有害事象の発生; 予期しないコストまたは遅延のリスク。 他の予期しないハードルのリスク。 Biogenのデータ、知的財産、その他の所有権、および知的財産の主張と課題に関連する不確実性を保護および実施しなかった場合。 現在および将来の医療制度改革に関連するリスク。 製造物責任請求; サードパーティのコラボレーションのリスク。 進行中のCOVID-19パンデミックがBiogenの事業、経営成績および財政状態に及ぼす直接的および間接的な影響。 上記は、すべてではありませんが、実際の結果が将来の見通しに関する記述におけるBiogenの期待と異なる可能性がある要因の多くを示しています。 投資家は、この注意事項と、Biogenの最新の年次または四半期報告書およびBiogenが米国証券取引委員会に提出したその他の報告書で特定されたリスク要因を考慮する必要があります。 これらの声明は、Biogenの現在の信念と期待に基づいており、このニュースリリースの日付の時点でのみ述べられています。 Biogenは、新しい情報、将来の開発、またはその他の結果として、将来の見通しに関する記述を公に更新する義務を負わないものとします。
Copyright 2022 JCNNewswire。 全著作権所有。 www.jcnnewswire.comBiogenInc。およびEisaiCo。、Ltd。(東京、日本)は本日、静脈内使用のためのADUHELM(aducanumab-avwa)4 mg / mL注射の第100相市販後確認試験ENVISIONに関する追加の詳細を発表しました。多様な登録と主要評価項目に関する研究の目標の詳細を含む、初期のアルツハイマー病。 出典:https://www.jcnnewswire.com/pressrelease/72730/3/
- &
- 000
- 100
- 2020
- 2022
- 私たちについて
- アクセス
- 越えて
- 行為
- 活動
- Ad
- NEW
- 住所
- アドバイス
- すべて
- 既に
- しかし
- アメリカ
- アメリカ人
- 間で
- 分析
- 発表の
- 毎年恒例の
- 障壁
- さ
- 利点
- ベータ
- バイオテクノロジー
- ビルド
- ビジネス
- コール
- これ
- 原因となる
- 課題
- チャールズ
- クレーム
- 臨床試験
- 認知
- 環境、テクノロジーを推奨
- 委員会
- コミットメント
- コマンドと
- コミュニティ
- 企業
- 会社
- 条件
- 混乱
- 含まれています
- 協同組合
- 著作権
- コスト
- 可能性
- コロナ
- COVID-19パンデミック
- 電流プローブ
- データ
- 遅延
- 配信する
- 開発
- 進展
- 異なる
- 病気
- 病気
- 多様性
- 薬
- 早い
- 初期段階
- エコシステム
- 効果
- エンドポイント
- 株式
- 推定
- イベント
- 交換
- 予想される
- 体験
- 要因
- 不良解析
- 家族
- FDA
- 特徴
- ファイナンス
- ファイナンシャル
- 名
- フィットネス
- フォーカス
- 将来を見据えた
- フル
- function
- 未来
- 生成する
- グローバル
- グローバルネットワーク
- 目標
- 健康
- ヘルスケア
- ヘルスケア
- 助けます
- ハイ
- HTTPS
- ハードル
- 実装する
- 重要
- (株)
- 含めて
- 増える
- 産業
- 情報
- イニシアチブ
- 機関
- 保険
- 統合された
- 知的
- 知的財産
- インベントリー
- 主要株主
- 問題
- 日本
- 7月
- キー
- より大きい
- 主要な
- 賠償責任
- 訴訟
- 製造業
- マーケティング
- だけど
- メディア
- 医療の
- メディケア
- 百万
- ヶ月
- 最も
- 国民
- ネットワーク
- ニュース
- 提供
- 業務執行統括
- 組織
- その他
- さもないと
- パンデミック
- 参加者
- 参加する
- パートナー
- のワークプ
- 薬剤
- 相
- 哲学
- プラットフォーム
- 人口
- ポートフォリオ
- プレゼンテーション
- プライベート
- プロダクト
- 製品
- 専門家
- プロフィール
- プログラム
- 財産
- 守る
- は、大阪で
- 公共
- R&D
- 価格表
- 反応
- レギュレータ
- 依存
- 名高い
- レポート
- レポート
- 研究
- 研究開発
- 結果
- 小売業者
- リスク
- 危険因子
- 安全な
- 安全性
- 前記
- 規模
- 科学
- 科学
- 二次
- 有価証券
- 証券取引委員会
- サービス
- セッションに
- 同様の
- サイト
- 小さい
- So
- ステージ
- 都道府県
- ステートメント
- 戦略的
- 作戦
- 研究
- 勉強
- かなりの
- サポート
- 表面
- ターゲット
- 介して
- 時間
- 今日
- 東京
- 最適化の適用
- 治療する
- 治療
- トライアル
- 私達
- 米国証券取引委員会
- アップデイト
- 通常
- Verification
- ビジョン
- この試験は
- 誰
- 受賞者
- 無し
- 言葉
- 仕事
- 年