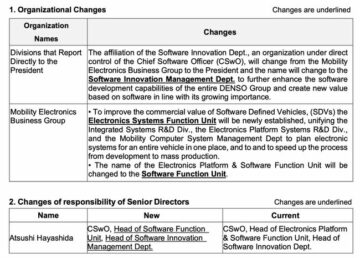
TOKYO, 19 januari 2022 – (JCN Newswire) – Eisai Co., Ltd. tillkännagav idag att DIAN-TU (Dominantly Inherited Alzheimer Network Trials Unit), ledd av Washington University School of Medicine i St. Louis, har registrerat den första ämne i fas II/III-studien (Tau NexGen-studien). Studien kommer att utvärdera effekten av Eisais undersökningsanti-mikrotubulibindande region (MTBR) tau-antikropp E2814, vid dominant ärftlig Alzheimers sjukdom (DIAD).
Människor som har genetiska mutationer av DIAD är kända för att utveckla Alzheimers sjukdom (AD) och kommer sannolikt att utveckla symtom vid ungefär samma ålder som deras drabbade föräldrar gjorde, ofta i 50-, 40- eller till och med 30-årsåldern. De viktigaste AD-patologierna är amyloidplack som består av amyloid beta (Abeta) aggregat; neurofibrillära trassel; och intraneuronala aggregat av tau, som alla antas spridas genom hjärnan.
Syftet med Tau NexGen-studien är att bedöma säkerheten, tolerabiliteten, biomarkören och kognitiv effekt av undersökningsterapier hos presymptomatiska eller symtomatiska deltagare som har en AD-orsakande genmutation. I mars 2021 valde DIAN-TU E2814, som skapades från ett forskningssamarbete mellan Eisai och University College London, som det första prövningsläkemedlet bland anti-tau-läkemedel för Tau NexGen-studien. Med ökande bevis från kliniska studier som visar att inriktning på amyloid kan minska biomarkörer för AD, valde Tau NexGens ledare för kliniska prövningar Eisais undersöknings anti-Abeta protofibril antikropp lecanemab (BAN2401) som bakgrundsbehandling mot amyloid, och studiens design ändrades i november 2021.
Eisai positionerar neurologi som ett centralt terapeutiskt område, och det kommer att fortsätta att skapa innovation i utvecklingen av nya läkemedel baserade på spjutspetsforskning inom neurologi, eftersom det försöker bidra ytterligare till att förbättra fördelarna för drabbade individer och deras familjer i sjukdomar med hög ouppfylld behov, såsom demens inklusive AD.
Om Dominantly Inherited Alzheimer Network (DIAN)
DIAN är en internationell forskningssatsning inriktad på dominant ärftlig Alzheimers sjukdom. Dominantly ärftlig Alzheimers sjukdom (DIAD) är en sällsynt form av Alzheimers sjukdom (AD) som orsakar minnesförlust och demens hos individer - vanligtvis när de är i 30- till 50-årsåldern. Sjukdomen drabbar mindre än 1 % av den totala befolkningen av personer med AD. Syftet med DIAN-TU (Dominantly Inherited Alzheimer Network Trials Unit) är att hitta lösningar för att behandla eller förebygga denna sjukdom och eventuellt alla former av Alzheimers. DIAN-TU är ett internationellt offentlig-privat partnerskap dedikerat till att utforma och hantera interventionella terapeutiska prövningar för individer med och i riskzonen för DIAD.
Om Tau NexGen studie
Syftet med Tau NexGen-studien är att bedöma säkerheten, tolerabiliteten, biomarkören och kognitiv effekt av undersökningsterapier hos personer som har en AD-orsakande genmutation. I Tau NexGen-studien kommer symtomatiska deltagare att administreras anti-amyloid beta (Abeta) protofibril antikropp lecanemab i sex månader innan de slumpmässigt tilldelas att även få anti-tau-läkemedlet eller placebo. Eftersom amyloidplack ackumuleras innan tau-trassel i AD, tillåter denna studiedesign forskarna att bedöma om amyloidavlägsnande gör vägen för anti-tau-läkemedlet att fungera mest effektivt. Presymptomatiska deltagare kommer att slumpmässigt tilldelas anti-tau-läkemedlet eller placebo i ett år innan administrering av lecanemab påbörjas. Genom att förväxla läkemedlen på detta sätt kommer forskarna att kunna utvärdera effekterna av anti-tau-läkemedlet enbart innan de bedömer effekterna av de två läkemedlen tillsammans. Om de primära och sekundära effektmåtten är positiva i analysen två år efter studiestart kommer studien att förlängas med ytterligare två år för att bedöma om läkemedlet bromsar kognitiv nedgång och har ytterligare effekter på tau-patologin.
Om E2814
En testande anti-mikrotubulibindande region (MTBR) tau-antikropp, E2814 utvecklas som ett sjukdomsmodifierande medel för tauopatier inklusive sporadisk AD. Kliniska fas I-studier pågår. E2814 upptäcktes som en del av forskningssamarbetet mellan Eisai och University College London. E2814 är utformad för att förhindra spridning av tau-frön i hjärnan hos drabbade individer.
Om Lecanemab (BAN2401)
Lecanemab är en humaniserad monoklonal antikropp mot AD som är resultatet av en strategisk forskningsallians mellan Eisai och BioArctic. Lecanemab binder selektivt för att neutralisera och eliminera lösliga, giftiga Abeta-aggregat (protofibriller) som tros bidra till den neurodegenerativa processen.
i annons. Som sådan kan lecanemab ha potential att ha en effekt på sjukdomspatologi och att bromsa utvecklingen av sjukdomen. När det gäller resultaten från förspecificerad analys efter 18 månaders behandling, visade studie 201 en minskning av hjärnans Abeta-ackumulering (P<0.0001) och en långsammare sjukdomsprogression mätt med ADCOMS* (P<0.05) hos patienter med tidiga AD. Studien uppnådde inte sitt primära resultatmått** efter 12 månaders behandling. Den öppna studie 201-förlängningen inleddes efter avslutad Core-period och en Gap-period från behandling (i genomsnitt 24 månader) för att utvärdera säkerhet och effekt, och är på gång.
Eisai erhöll de globala rättigheterna att studera, utveckla, tillverka och marknadsföra lecanemab för behandling av AD i enlighet med ett avtal som slöts med BioArctic i december 2007. I mars 2014 ingick Eisai och Biogen ett gemensamt utvecklings- och kommersialiseringsavtal för lecanemab och parterna ändrade det avtalet i oktober 2017. För närvarande studeras lecanemab i en pivotal klinisk fas III-studie i symtomatisk tidig AD (Clarity AD), efter resultatet av den kliniska fas II-studien (studie 201). I juli 2020 inleddes den kliniska fas III-studien (AHEAD 3-45) för individer med preklinisk AD, vilket innebär att de är kliniskt normala och har mellanliggande eller förhöjda nivåer av amyloid i hjärnan. AHEAD 3-45 genomförs som ett offentligt-privat partnerskap mellan Alzheimers Clinical Trial Consortium som tillhandahåller infrastrukturen för akademiska kliniska prövningar av AD och relaterade demenssjukdomar i USA, finansierat av National Institute on Aging, en del av National Institutes of Health och Eisai.
I september 2021 inleddes en rullande inlämning till FDA av en Biologics License Application (BLA) för behandling av tidig AD under den accelererade godkännandevägen. Lecanemab beviljades Breakthrough Therapy-beteckningen i juni 2021, ett program av amerikanska Food and Drug Administration (FDA) avsett att påskynda utvecklingen och granskningen av läkemedel för allvarliga eller livshotande tillstånd.
* Utvecklat av Eisai, ADCOMS (AD Composite Score) kombinerar objekt från ADAS-Cog (Alzheimers Disease Assessment Scale-cognitive subscale), CDR (Clinical Dementia Rating) och MMSE (Mini- Mental State Examination) skalorna för att möjliggöra en känslig upptäckt av förändringar i kliniska funktioner av tidiga AD-symtom och förändringar i minnet.
** En 80 % eller högre uppskattad sannolikhet för att visa 25 % eller mer avmattning i klinisk nedgång efter 12 månaders behandling mätt med ADCOMS från baslinjen jämfört med placebo
Medieförfrågningar:
Public Relations Department, Eisai Co., Ltd.
+81-(0)3-3817-5120
Eisai Inc (USA) Libby Holman 201-753-1945
Libby_Holman@eisai.com
Investerarkontakt:
Eisai Co., Ltd.
Avdelningen för investerarrelationer
TEL: +81-(0)70-8688-9685
Copyright 2022 JCN Newswire. Alla rättigheter förbehållna. www.jcnnewswire.comEisai Co., Ltd. tillkännagav idag att den Dominantly Inherited Alzheimer Network Trials Unit (DIAN-TU), ledd av Washington University School of Medicine i St. Louis, har registrerat det första ämnet i fas II/III-studien (Tau NexGen-studie). Källa: https://www.jcnnewswire.com/pressrelease/72519/3/
- 2020
- 2022
- Ad
- administreras
- Avtal
- Alla
- Alliance
- bland
- analys
- meddelade
- Ansökan
- OMRÅDE
- runt
- genomsnitt
- Baslinje
- Börjar
- Där vi får lov att vara utan att konstant prestera,
- Fördelarna
- beta
- kliniska tester
- kognitiv
- samverkan
- College
- fortsätta
- upphovsrätt
- Designa
- design
- Detektering
- utveckla
- utvecklade
- Utveckling
- DID
- upptäckt
- Sjukdom
- sjukdomar
- ner
- drog
- Läkemedel
- Tidig
- effekt
- familjer
- FDA
- Förnamn
- fokuserade
- livsmedelsproduktion
- formen
- fungera
- förbetalt
- spalt
- Välgörenhet
- Hälsa
- Hög
- HTTPS
- Inklusive
- Infrastruktur
- Innovation
- Internationell
- IT
- Juli
- Nyckel
- Led
- Licens
- london
- större
- Mars
- marknad
- läkemedel
- Minne
- månader
- mest
- nationell
- nät
- föräldrar
- Partnerskap
- Personer
- fas
- svängbara
- befolkning
- process
- Program
- ger
- minska
- forskning
- Resultat
- översyn
- Risk
- Säkerhet
- Skola
- sekundär
- frön
- vald
- SEX
- saktar
- Lösningar
- spridning
- starta
- Ange
- Strategisk
- studier
- Läsa på
- i dag
- tillsammans
- behandla
- behandling
- rättegång
- oss
- universitet
- washington
- VEM
- inom
- år
- år