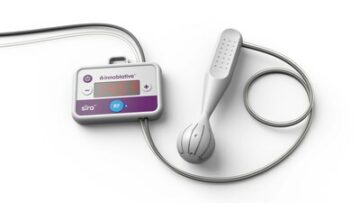
演示文稿详细介绍了 Biosense Webster 的全球多中心 STELLAR 研究结果
3年2023月XNUMX日,加利福尼亚州IRVINE /美通社/ 生物传感韦伯斯特公司,心律失常治疗领域的全球领导者,也是 强生医疗科技i宣布,公司赞助的 STELLAR 研究的积极结果作为最新突破性成果在第 28 届国际年会上公布,题为“用多电极射频球囊导管肺静脉隔离阵发性心房颤动:全球、多中心 STELLAR 研究的结果” AF 研讨会。
STELLAR 研究调查了使用 HELIOSTAR™ 球囊消融导管进行肺静脉隔离 (PVI) 治疗药物难治性症状性阵发性心房颤动 (AFib) 的安全性和有效性。 这项研究是迄今为止规模最大的临床研究,对 HELIOSTAR™ 球囊消融导管进行了为期 12 个月的随访数据。
在分析中,98.8% 的受试者实现了急性 PVI,93.0% 的受试者未额外使用局灶性导管。 大多数 PVI 是在不需要焦点修饰的情况下实现的。 12 个月时的主要有效性为 67.7%,>90% 的患者在 12 个月时没有重复消融。 此外,临床成功率(在研究中定义为 12 个月内没有症状性房性心律失常复发)为 77.7%。1
亚特兰大皮埃蒙特医院电生理学实验室主任、医学博士、FHRS Sandeep Goyal 表示:“随着 AFib 的日益流行,在不同市场和患者群体中评估创新工具非常重要,以便为跨地区的患者提供价值。”作为 STELLAR 研究的研究者ii。 “这项研究的结果进一步证明了射频球囊导管如何成为电生理学家治疗 AFib 的重要工具。”
STELLAR 研究是在美国、中国和意大利进行的一项受 FDA 监管的研究性器械豁免研究,旨在评估使用 HELIOSTAR ™球囊消融导管治疗难治性症状性阵发性 AFib 的 PVI 的安全性和有效性。2
HELIOSTAR™ 球囊消融导管是 EMEA 批准用于心脏消融的第一款射频球囊消融导管。 HELIOSTAR™ 球囊消融导管与 CARTO™ 3 系统完全集成,为 PVI 实现了高效、可定制和简化的透视工作流程。3 HELIOSTAR™ 球囊消融导管未在美国获得批准。
“Biosense Webster 致力于与 EP 界合作,开发安全、有效和高效的工具来治疗心律失常,使 AFib 患者能够过上他们想要的生活,”临床前和临床研究及医学副总裁 Anthony Hong 说道。 Biosense Webster, Inc. 事务部“我们很高兴 STELLAR 研究的分析强化了 HELIOSTAR™ 球囊消融导管在治疗药物难治性症状性阵发性房颤方面的价值。”
关于恒星
STELLAR 研究是对多电极射频球囊导管的关键、前瞻性、多中心、单臂临床评估。 该研究将评估用于阵发性房颤 (PAF) 患者消融的多电极射频球囊导管的安全性和有效性。
关于 Biosense Webster
Biosense Webster, Inc. 是心律失常诊断和治疗科学技术领域的全球市场领导者。 这家专业医疗技术公司是 Johnson & Johnson MedTech 的一部分,总部位于加利福尼亚州欧文市,在全球范围内致力于开发可帮助电生理学家识别、治疗和提供护理的工具和解决方案。 了解更多信息 www.biosensewebster.com 并连接 LinkedIn 和 Twitter.
关于强生医疗科技i
在 Johnson & Johnson MedTechi,我们释放多样化的医疗保健专业知识、有目的的技术和对人们的热情,以改变医疗干预的未来,并使每个人都能过上最好的生活。 一个多世纪以来,我们推动了突破性的科学创新,以解决未满足的需求并重新构想健康。 在外科、骨科、视力和介入解决方案方面,我们继续帮助挽救生命,并创造一个医疗保健解决方案更智能、侵入性更小、更个性化的未来。
关于前瞻性声明的注意事项
本新闻稿包含 1995 年《私人证券诉讼改革法案》中定义的有关 HELIOSTAR™ 球囊消融导管的“前瞻性声明”。 请读者不要依赖这些前瞻性陈述。 这些陈述基于当前对未来事件的预期。 如果基本假设被证明不准确或出现已知或未知的风险或不确定性,则实际结果可能与 Biosense Webster, Inc.、任何其他强生医疗科技公司和/或强生公司的预期和预测存在重大差异。 风险和不确定性包括但不限于:监管审批的不确定性; 商业成功的不确定性; 专利挑战; 竞争,包括竞争对手获得的技术进步、新产品和专利; 产品功效或安全问题导致产品召回或监管行动; 适用法律和法规的变更,包括全球医疗保健改革; 医疗保健产品和服务购买者的行为和消费模式发生变化; 以及医疗保健成本控制的趋势。 有关这些风险、不确定性和其他因素的进一步列表和描述,请参阅强生公司截至 10 年 2 月 2022 日的财年 1-K 表格年度报告,包括标题为“有关前瞻性陈述的警示说明”的部分。 ”和“第 10A 项。 风险因素”以及强生公司随后向美国证券交易委员会提交的 XNUMX-Q 表格季度报告和其他文件中的内容。 这些文件的副本可在线获取: www.sec.gov, 强生网 或根据强生公司的要求。 Biosense Webster, Inc.、Johnson & Johnson MedTech Companies 和 Johnson & Johnson 均不承诺根据新信息或未来事件或发展更新任何前瞻性陈述。
© Biosense Webster, Inc. 2023
238381-230124
i 强生医疗科技部门包括强生医疗科技部门的手术、骨科、视力和介入解决方案业务。
ii Piedmont Healthcare, Inc. 与 Biosense Webster, Inc. 就参与 STELLAR 研究签订了临床试验协议。 Goyal 博士担任试验调查员,并没有因作者贡献而获得报酬。
1 Goyal、Sandeep K. 等人。 用多电极射频球囊导管隔离阵发性心房颤动的肺静脉:来自全球、多中心、STELLAR 研究的结果 [摘要]。 在:AF 研讨会。 2 月 4 日至 XNUMX 日; 波士顿。
2 临床试验.gov。 多电极射频球囊导管治疗症状性阵发性心房颤动(STELLAR)的安全性和有效性评价 https://clinicaltrials.gov/ct2/show/NCT03683030。 访问了1月11,2023。
3 SHINE 主要文章 Schilling Europace 2021; 23(6):851-860。
媒体联络:
黛安·普雷斯曼
908-295-0857
Dpressm1@its.jnj.com
夏琳德巴尔
714-727-8677
Cdebar1@its.jnj.com
投资者关系联系方式:
莎拉·伍德(Sarah Wood)
908-218-3560
Swood15@its.jnj.com
消息来源 Biosense Webster, Inc.
- SEO 支持的内容和 PR 分发。 今天得到放大。
- 柏拉图区块链。 Web3 元宇宙智能。 知识放大。 访问这里。
- Sumber: https://www.biospace.com/article/releases/late-breaking-data-on-pulmonary-vein-isolation-with-heliostar-balloon-ablation-catheter-presented-at-af-symposium-2023/?s=93
- 11
- 12个月
- 2021
- 2022
- 2023
- 67
- 77
- 98
- a
- 摘要
- 访问
- 实现
- 横过
- 法案
- 操作
- 增加
- 额外
- 地址
- 推进
- 进步
- 协议
- 分析
- 和
- 公布
- 全年
- Anthony
- 相应
- 批准
- 刊文
- 亚特兰大
- 著作权
- 可使用
- 基于
- 背后
- 最佳
- 生物空间
- 波士顿
- 破坏
- 突破
- 企业
- 加州
- 关心
- 世纪
- 挑战
- 更改
- 中国
- 临床资料
- COM的
- 商业的
- 佣金
- 提交
- 社体的一部分
- 公司
- 公司
- 补偿
- 竞争
- 竞争对手
- 关注
- 分享链接
- CONTACT
- 联系
- 遏制
- 包含
- 内容
- 继续
- 捐款
- 价格
- 可以
- 创建信息图
- 电流
- 定制
- data
- 日期
- 定义
- 交付
- 详情
- 发展
- 设备
- 副总经理
- 不同
- 下载
- 驱动
- 药物
- 有效
- 效用
- 高效
- 欧洲与中东地区
- 授权
- 使
- 进入
- 醚(ETH)
- 评估
- 评估
- 评估
- 事件
- 每个人
- 证据
- 交换
- 期望
- 专门知识
- 因素
- 姓氏:
- 税法
- 申请
- 前瞻性的
- 发现
- Free
- Freedom
- 止
- 充分
- 进一步
- 未来
- 全球
- 全球健康
- 全球市场
- 成长
- 总部设
- 健康管理
- 卫生保健
- 医疗保健
- 帮助
- 香
- 医院
- 创新中心
- HTML
- HTTPS
- 鉴定
- 图片
- 重要
- in
- 不准确
- 公司
- 包括
- 包含
- 信息
- 創新
- 创新
- 集成
- 国际
- 介入
- 隔离
- IT
- 意大利
- 一月
- 约翰逊
- 已知
- 实验室
- 最大
- 晚了
- 法律
- 法律法规
- 领导者
- 学习用品
- 生活
- 有限
- 清单
- 诉讼
- 生活
- 生活
- 多数
- 市场
- 市场领导者
- 市场
- 重大
- 医生
- 医疗技术
- 个月
- 更多
- 多媒体
- 需要
- 需要
- 也不
- 全新
- 新产品
- 在线
- 原版的
- 骨科
- 其他名称
- 部分
- 参与
- 情
- 专利
- 病人
- 患者
- 模式
- 员工
- 个性化你的
- 关键的
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 满意
- 人群
- 积极
- 可能
- 呈现
- 总统
- express
- 新闻报道
- 小学
- 私立
- 美通社
- 产品
- 热销产品
- 产品与服务
- 预测
- 证明
- 提供
- 率
- 读者
- 复发
- 减少
- 改革
- 关于
- 地区
- 法规
- 监管
- 关系
- 释放
- 依靠
- 重复
- 报告
- 业务报告
- 请求
- 研究
- 导致
- 导致
- 成果
- 风险
- 风险因素
- 风险
- 安全
- 实现安全
- 说
- 保存
- 科学
- 科学与技术
- 证券交易委员会
- 部分
- 证券
- 美国证券交易委员会
- 段
- 特色服务
- 闪耀
- 聪明
- So
- 解决方案
- 专门
- 花费
- 个人陈述
- 声明
- 恒星
- 学习
- 随后
- 成功
- 手术
- 专题研讨会
- 系统
- 技术性
- 专业技术
- 未来
- 世界
- 其
- 标题
- 至
- 工具
- 工具
- 对于
- 改造
- 治疗
- 治疗
- 治疗
- 趋势
- 试用
- 不确定性
- 不确定
- 相关
- 发挥
- 更新
- us
- 使用
- 折扣值
- 各个
- 副总裁
- 查看
- 愿景
- WHO
- 将
- 中
- 也完全不需要
- 工作流程
- 加工
- 合作
- 世界
- 年
- 和风网