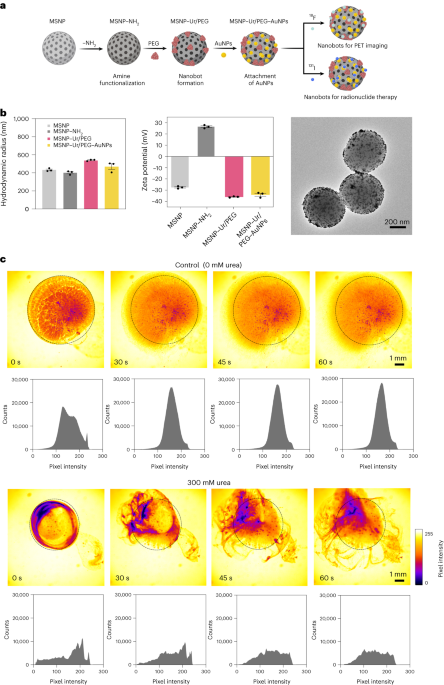
Σύνθεση Nanobot
Τα Nanobots παρασκευάστηκαν όπως περιγράφηκε προηγουμένως33. Εν συντομία, τα MSNP συντέθηκαν χρησιμοποιώντας μια τροποποιημένη μέθοδο Stöber41, τριαιθανολαμίνη που αντιδρά (35 g), υπερκαθαρό νερό (20 ml) και βρωμιούχο εξαδεκυλοτριμεθυλαμμώνιο (CTAB; 570 mg) στους 95 °C για 30 min υπό ανάδευση. Ορθοπυριτικό τετρααιθυλεστέρα (1.5 ml) προστέθηκε στη συνέχεια στάγδην. το μίγμα αφέθηκε να αντιδράσει για 2 ώρες στους 95°C και τα προκύπτοντα MSNP συλλέχθηκαν με φυγοκέντρηση και πλύθηκαν σε αιθανόλη (τρεις φορές, 2,500g, 5 λεπτά). Για να αφαιρεθεί το πρότυπο CTAB, τα MSNP τοποθετήθηκαν υπό αναρροή σε όξινη μεθανόλη (1.8 ml HCl, 30 ml μεθανόλη) για 24 ώρες. Στη συνέχεια, τα MSNP συλλέχθηκαν με φυγοκέντρηση και πλύθηκαν τρεις φορές σε αιθανόλη (2,500g, 5 min) πριν από την ενσωμάτωση της τροποποίησης αμίνης με την προσθήκη APTES (6 μl ανά mg MSNP) σε MSNPs (1 mg ml-1) σε αιθανολικό διάλυμα 70% στους 70 °C, αναδεύοντας ζωηρά για 1 h. MSNPs-NH2 συλλέχθηκαν και πλύθηκαν τρεις φορές σε αιθανόλη και τρεις φορές σε νερό με φυγοκέντρηση (τρεις φορές, 1,150g, 5 λεπτά). MSNPs-NH2 επαναιωρήθηκαν σε PBS σε συγκέντρωση 1 mg/ml-1 και συνολικός όγκος 900 μl και ενεργοποιήθηκε με γλουταραλδεΰδη (100 μl) για 2.5 h σε θερμοκρασία δωματίου. Τα ενεργοποιημένα MSNPs-NH2 συλλέχθηκαν και πλύθηκαν σε PBS τρεις φορές με φυγοκέντρηση (1,150g, 5 min), επαναιωρημένο σε διάλυμα ουρεάσης (3 mg ml-1) και ετεροδιλειτουργικό PEG (1 μg PEG ανά mg 5 kDa HS-MSNPs-NH2) σε PBS και αντέδρασε για 24 h σε θερμοκρασία δωματίου. Τα προκύπτοντα nanobots στη συνέχεια συλλέχθηκαν και πλύθηκαν τρεις φορές σε PBS με φυγοκέντρηση (1,150g, 5 min) πριν τα επαναιωρήσετε σε μια διασπορά AuNPs, που παρασκευάστηκε όπως περιγράφηκε προηγουμένως51, αφήνοντάς τα να αντιδράσουν για 10 min και πλύθηκαν καλά με φυγοκέντρηση (τρεις φορές, 1,150g, 5 λεπτά).
Υδροδυναμική κατανομή μεγέθους και επιφανειακό φορτίο των MSNPs, MSNPs-NH2, τα νανορομπότ και τα νανορομπότ διακοσμημένα με AuNP προσδιορίστηκαν χρησιμοποιώντας ένα σύστημα δυναμικής σκέδασης φωτός Wyatt Mobius και ένα Malvern Zetasizer, αντίστοιχα. Σε όλες τις περιπτώσεις, η συγκέντρωση ήταν 20 μg ml-1 και χρόνος απόκτησης 5 s, χρησιμοποιώντας τρεις εκτελέσεις ανά πείραμα. Πραγματοποιήθηκαν τρεις μετρήσεις ανά τύπο σωματιδίου.
Σύνθεση FITC MSNP
Παρασκευάστηκε ένα μείγμα FITC (2 mg), αιθανόλης (5 ml) και APTES (400 μl) και αναδεύτηκε για 30 λεπτά. Στη συνέχεια, ακολουθήθηκε το πρωτόκολλο που περιγράφηκε προηγουμένως για τη σύνθεση MSNP, εκτός από το ότι προσθέσαμε στάγδην ορθοπυριτικό τετρααιθυλεστέρα (1.25 ml) σε συνδυασμό με το μείγμα FITC-APTES (250 μl). Τα βήματα λειτουργικότητας για την απόκτηση νανορομπότ με σήμανση FITC ήταν όπως προαναφέρθηκε.
Σύνθεση AuNPs
Τα AuNP συντέθηκαν χρησιμοποιώντας μια αναφερόμενη μέθοδο33. Εν συντομία, όλα τα υλικά καθαρίστηκαν χρησιμοποιώντας πρόσφατα παρασκευασμένο aqua regia, ξεπλύθηκαν καλά με νερό και στέγνωσαν στον αέρα. Στη συνέχεια, ένα 1 mM AuCl4 Το διάλυμα θερμάνθηκε μέχρι το σημείο βρασμού του ενώ αναδεύτηκε σε φιάλη με στρογγυλό πυθμένα ενσωματωμένη σε σύστημα αναρροής. Στη συνέχεια, προστέθηκαν 10 ml διαλύματος κιτρικού νατρίου (30.8 mM) και το διάλυμα έβρασε για 20 λεπτά, με αποτέλεσμα να αποκτήσει κόκκινο χρώμα. Το διάλυμα στη συνέχεια αφέθηκε να ψυχθεί σε θερμοκρασία δωματίου ενώ αναδεύτηκε για 1 ώρα. Τα προκύπτοντα AuNP αποθηκεύτηκαν στο σκοτάδι και ο χαρακτηρισμός διεξήχθη χρησιμοποιώντας ηλεκτρονικό μικροσκόπιο μετάδοσης.
Ενζυματική δραστηριότητα
Ενζυματική δραστηριότητα των νανορομπότ, 18F-nanobots και 131Τα I-nanobots μετρήθηκαν χρησιμοποιώντας κόκκινο φαινόλης. Για να γίνει αυτό, 2 µl nanobots (1 mg ml-1) προστέθηκαν σε πλάκα 96 φρεατίων και αναμίχθηκαν με 200 μl διαφορετικών διαλυμάτων ουρίας (0, 50, 100, 200 mM) σε ερυθρό φαινόλης 1.1 mM. Η απορρόφηση στα 560 nm μετρήθηκε με την πάροδο του χρόνου στους 37 °C.
Δυναμική κίνησης Nanobot μέσω οπτικού μικροσκοπίου
Τα οπτικά βίντεο των νανορομπότ αποκτήθηκαν χρησιμοποιώντας ένα μικροσκόπιο Leica Thunder, σε συνδυασμό με κάμερα CCD υψηλής ταχύτητας Hamamatsu και αντικειμενικό φακό ×1.25. Για αυτό, τα nanobots φυγοκεντρήθηκαν και επαναιωρήθηκαν σε 50 μl PBS (τελική συγκέντρωση 20 mg ml-1). Στη συνέχεια, ένα τρυβλίο Petri γεμίστηκε με 3 ml είτε PBS είτε με διάλυμα ουρίας 300 mM (σε PBS) και παρατηρήθηκε στο μικροσκόπιο. Μια σταγόνα 5 μl με nanobots (20 mg/ml-1) στη συνέχεια προστέθηκε στο γεμάτο με υγρό τρυβλίο Petri και καταγράφηκαν βίντεο με ταχύτητα 25 καρέ ανά δευτερόλεπτο. Οι κατανομές της έντασης των εικονοστοιχείων βίντεο σε ROI αναλύθηκαν σε διαστήματα 15 s χρησιμοποιώντας το λογισμικό ImageJ.
Ραδιοσήμανση νανορομπότ με [18F]F-PyTFP
Σύνθεση [18F]F-PyTFP
[18Το F]F-PyTFP συντέθηκε σε μια μονάδα Neptis xSeed (Βελτιστοποιημένες Ραδιοχημικές Εφαρμογές), ακολουθώντας μια μέθοδο που αναφέρθηκε προηγουμένως33.
Σύνθεση του 18Νανορομπότ με σήμανση F
Τα νανορομπότ επισημάνθηκαν με [18F]F-PyTFP, βάσει προηγουμένως καθιερωμένης διαδικασίας με μικρές τροποποιήσεις33. Εν συντομία, 200µl διαλύματος nanobot (1mg ml-1) φυγοκεντρήθηκε (10 min, 13,853g), επαναιωρήθηκε σε 10 μl PBS (1 mM, pH 8) και επωάστηκε με 4 μl [18F]F-PyTFP σε ακετονιτρίλιο (περίπου 37 MBq) για 35 min σε θερμοκρασία δωματίου. Μετά την επώαση, το μίγμα της αντίδρασης αραιώθηκε με νερό (200 μl) και καθαρίστηκε με φυγοκέντρηση (5 λεπτά, 13,853g). Το προκύπτον σφαιρίδιο στη συνέχεια ξεπλύθηκε τρεις φορές με νερό πριν μετρηθεί σε βαθμονομητή δόσης (CPCRC-25R, Capintec). Η ραδιοχημική απόδοση υπολογίστηκε ως η αναλογία μεταξύ της ποσότητας ραδιενέργειας που υπάρχει στα νανορομπότ μετά το πλύσιμο και της αρχικής ποσότητας ραδιενέργειας. Η ραδιοχημική καθαρότητα μετά τον καθαρισμό ήταν ≥99%, όπως προσδιορίστηκε με ραδιοχρωματογραφία λεπτής στιβάδας (radio-TLC) χρησιμοποιώντας χαρτί χρωματογραφίας iTLC-SG (Agilent Technologies) και διχλωρομεθάνιο και μεθανόλη (2:1) ως σταθερή και κινητή φάση, αντίστοιχα. Οι πλάκες TLC αναλύθηκαν χρησιμοποιώντας συσκευή ανάγνωσης TLC (MiniGITA, Raytest).
Σταθερότητα του 18F-nanobots
Η σταθερότητα του 18Τα νανορομπότ με σήμανση F προσδιορίστηκαν χρησιμοποιώντας τα ακόλουθα μέσα: (1) 300 mM ουρία, (2) νερό και (3) ούρα από ζώα που φέρουν όγκο. 18Νανορομπότ με σήμανση F (10 μl) επωάστηκαν με το αντίστοιχο διάλυμα (100 μl) για 1 ώρα σε θερμοκρασία δωματίου. Στη συνέχεια, τα νανορομπότ και το υπερκείμενο διαχωρίστηκαν με φυγοκέντρηση και συλλέχθηκαν και η ραδιενέργεια μετρήθηκε σε βαθμονομητή δόσης (CPCRC-25R).
Ραδιοσήμανση νανορομπότ με 131I
Η ραδιοϊωδίωση των νανορομπότ ουρεάσης πραγματοποιήθηκε με επώαση νανορομπότ με ενέσιμα [131Διάλυμα I]NaI (925 MBq ml-1; GE HealthCare). Εν συντομία, 400 μl διαλύματος nanobot ουρεάσης (1 mg ml-1) φυγοκεντρήθηκε (13,853g, 5 min), επαναιωρήθηκε σε 100 μl PBS (10 mM, pH 7.4) και επωάστηκε με 25 μl ή 185 μl ενέσιμου [131I]NaI (περίπου 42.55 ή 277.5 MBq, αντίστοιχα) για 30 min, ανάλογα με την επιθυμητή τελική δραστηριότητα. Μετά την επώαση, το μίγμα της αντίδρασης καθαρίστηκε με φυγοκέντρηση (13,853g, 5 λεπτά). Το προκύπτον ίζημα πλύθηκε τρεις φορές με νερό (100 μΐ). Η ραδιενέργεια στο υπερκείμενο και το ίζημα προσδιορίστηκε χρησιμοποιώντας βαθμονομητή δόσης (CPCRC-25R) και τα δύο κλάσματα αναλύθηκαν με ραδιο-TLC, όπως για 18F-nanobots.
Ανάπτυξη ζωικού μοντέλου
Τα ποντίκια συντηρήθηκαν και χειρίστηκαν σύμφωνα με την Οδηγία 2010/63/UE του Ευρωπαϊκού Συμβουλίου και τις εσωτερικές οδηγίες. Όλες οι πειραματικές διαδικασίες εγκρίθηκαν από την επιτροπή δεοντολογίας της CIC biomaGUNE και τις τοπικές αρχές (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Η ανάλυση εικόνας (τόσο PET όσο και MRI) τυφλώθηκε ως προς την ομαδική κατανομή των ζώων.
Το ορθοτοπικό μοντέλο ποντικού καρκίνου της ουροδόχου κύστης δημιουργήθηκε με ενδοκυστική χορήγηση κυττάρων ΜΒ49 (κυτταρική σειρά καρκινώματος ουροδόχου κύστης ποντικού) σε θηλυκά ποντίκια C57BL/6JRj (ηλικίας 8 εβδομάδων, Janvier). Για πειράματα που στοχεύουν στον προσδιορισμό της συσσώρευσης όγκου (τέσσερις ομάδες· λεπτομέρειες παρακάτω), εμβολιάστηκαν έξι ζώα ανά ομάδα, όπως προσδιορίστηκε με ανάλυση ακριβείας, με τις ακόλουθες υποθέσεις: απαιτούμενη ακρίβεια, 20%; αναμενόμενο s.d., ±20%; εμπιστοσύνη, 95%; απώλεια ζώων, 20%. Για πειράματα θεραπευτικής αποτελεσματικότητας (έξι ομάδες· λεπτομέρειες παρακάτω), συμπεριλήφθηκαν δέκα ζώα ανά ομάδα, όπως υπολογίστηκε με χρήση μαθητή με μονή ουρά t-Δοκιμή, διαφορά μεταξύ δύο ανεξάρτητων μέσων, με τις ακόλουθες παραδοχές: μηδενική υπόθεση, η θεραπεία δεν επηρεάζει την ανάπτυξη του όγκου. α0.05; 1 − β0.95; s.d., ±50%; αναμενόμενες διαφορές μεταξύ των ομάδων, 50%. απώλεια ζώων, 20%. Καθώς το πείραμα διεξήχθη σε δύο παρτίδες για λειτουργικούς λόγους, μια ομάδα ελέγχου συμπεριλήφθηκε και στις δύο παρτίδες (Πίνακας 2), και στη συνέχεια όλα τα ζώα συνενώθηκαν. Για την εγκατάσταση του όγκου, τα ποντίκια αναισθητοποιήθηκαν με εισπνοή 3% ισοφλουρανίου σε καθαρό Ο2 και διατηρείται από 1.0-1.5% ισοφλουράνιο σε 100% Ο2. Στη συνέχεια, η κύστη αδειάστηκε και προκλήθηκαν χημικές βλάβες στο ουροθήλιο με ενδοκυστική ενστάλαξη 50 μl πολυ-l-λυσίνη (Sigma-Aldrich) μέσω καθετήρα 24-gauge για 15 λεπτά. Στη συνέχεια, η κύστη εκκενώθηκε ξανά και τα κύτταρα MB49 (105 κύτταρα) σε DMEM υψηλής γλυκόζης (100 μl) ενστάλαξαν για 1 ώρα πριν αφαιρεθεί ο καθετήρας και εκκενωθεί η κύστη με κοιλιακό μασάζ. Καθ' όλη τη διάρκεια των πειραμάτων, τα ποντίκια παρακολουθήθηκαν και ζυγίστηκαν για παρακολούθηση της υγείας και της ευημερίας. Εφαρμόστηκε τελικό σημείο για τον άνθρωπο εάν η απώλεια βάρους υπερέβαινε το 20% ή βάσει κλινικών συμπτωμάτων, σύμφωνα με τα κριτήρια του υπεύθυνου κτηνιάτρου.
Παρακολούθηση μεγέθους όγκου
Οι μελέτες μαγνητικής τομογραφίας διεξήχθησαν 7 και 14 ημέρες μετά την πρόκληση όγκου, χρησιμοποιώντας έναν σαρωτή 7 T Bruker BioSpec USR 70/30 (Bruker BioSpin) εξοπλισμένο με ένθετο βαθμίδωσης BGA-12S 440 mT m-1 και αντηχείο 112/086 QSN (T12053V3) για ραδιοσυχνότητες14 μετάδοσης και ένα πηνίο επιφάνειας εγκεφάλου αρουραίου (T11205V3) για λήψη ραδιοσυχνοτήτων (και τα δύο λειτουργούν στα 300 MHz). Τα ζώα αναισθητοποιήθηκαν με ισοφλουράνιο (4% για επαγωγή και 1.5% για συντήρηση σε 50% Ο2/50% Ν2 μείγμα) και τοποθετείται σε βάση συμβατή με MR. Η θερμοκρασία του σώματος και ο ρυθμός αναπνοής παρακολουθούνταν συνεχώς χρησιμοποιώντας μια συσκευή παρακολούθησης συμβατή με MR (μοντέλο 1030 SA, Small Animal Instruments), συνδεδεμένη με ένα σύστημα θέρμανσης αέρα μικρών τρωκτικών για τη διατήρηση της θερμοκρασίας του σώματος. Μετά τη λήψη εικόνων αναφοράς, χρησιμοποιήθηκε μια ακολουθία απεικόνισης με βαρύτητα διάχυσης που βασίζεται σε spin για την απεικόνιση όγκων, χρησιμοποιώντας τις ακόλουθες παραμέτρους: χρόνος ηχούς (TE) = 22.3 ms, χρόνος επανάληψης (TR) = 2,500 ms, n = 2 μέσοι όροι, μία εικόνα A0 (βασική εικόνα με b = 0 s mm-2) και μία εικόνα DW που αποκτήθηκε με χρήση διαβαθμίσεων διάχυσης στην κατεύθυνση (1, 0, 0) με διάρκεια διαβάθμισης δ = 4.5 ms και διαχωρισμός κλίσης Δ = 10.6 ms, δίνοντας b = 650 s mm-2, ένα 16 × 16 mm2 οπτικό πεδίο, μέγεθος μήτρας εικόνας 160 × 160 σημείων, 20 διαδοχικές φέτες πάχους 0.5 mm (χωρίς κενό, αποκτάται σε λειτουργία παρεμβολής) και εύρος ζώνης 192.9 Hz ανά pixel. Για την οπτικοποίηση των όγκων, οι εικόνες υποβλήθηκαν σε μεταγενέστερη επεξεργασία με το λογισμικό ImageJ, διαιρώντας τις εικόνες που αποκτήθηκαν με μια κλίση διάχυσης (b = 650 s mm-2) από όσους αποκτήθηκαν χωρίς (b = 0 s mm-2), και εφαρμόζοντας ένα τρισδιάστατο φίλτρο Gauss (σx = σy = σz = 0.7) στο αποτέλεσμα. Οι όγκοι σκιαγραφήθηκαν με το χέρι για να προσδιοριστεί ο όγκος τους.
Βιοκατανομή in vivo
Την ημέρα 15 μετά την επαγωγή όγκου, τα ποντίκια τυχαιοποιήθηκαν σε τέσσερις ομάδες για να λάβουν ομοιογενείς κατανομές μέσου όγκου όγκου μεταξύ των ομάδων. Οι σαρώσεις PET-CT (σαρωτές MOLECUBES β και X-CUBE) αποκτήθηκαν 3 h μετά την ενδοκυστική χορήγηση 100 μl 18F-BSA (ομάδες 1 και 2) ή 18Νανορομπότ F-ουρεάσης (ομάδες 3 και 4) σε συγκέντρωση 200 μg ml-1, χρησιμοποιώντας είτε νερό (ομάδες 1 και 3) είτε 300 mM ουρίας σε νερό (ομάδες 2 και 4) ως όχημα (Πίνακας 1). Για τη λήψη εικόνας, τα ζώα προκλήθηκαν με αναισθησία (5% ισοφλουράνιο σε καθαρό οξυγόνο) και τοποθετήθηκαν σε ύπτια θέση πριν κάνουν μασάζ στην κοιλιακή περιοχή για εκκένωση της ουροδόχου κύστης. Αμέσως μετά το αντίστοιχο 18Νανορομπότ με σήμανση F (18F-BSA/18F-ουρεάση σε νερό/ουρία) ενστάλαξαν στην ουροδόχο κύστη μέσω καθετήρα 24 διαμετρημάτων και επωάστηκαν για 1 ώρα, πριν αφαιρεθεί ο καθετήρας, αδειάσει την κύστη και αφήσει τα ποντίκια να αναρρώσουν από την αναισθησία. Στο t = 3 h μετά τη χορήγηση, τα ζώα αναισθητοποιήθηκαν εκ νέου και λήφθηκαν 10 λεπτές στατικές εικόνες PET ολόκληρου του σώματος, ακολουθούμενες από αξονικές τομογραφίες. Οι εικόνες PET ανακατασκευάστηκαν χρησιμοποιώντας τον αλγόριθμο ανακατασκευής μεγιστοποίησης προσδοκιών με διατεταγμένο 3D υποσύνολο με τυχαίες διορθώσεις, διασποράς και εξασθένησης. Οι εικόνες PET-CT του ίδιου ποντικιού συν-καταχωρίστηκαν και αναλύθηκαν χρησιμοποιώντας το εργαλείο επεξεργασίας εικόνας PMOD. Τα διαγράμματα συγκέντρωσης ραδιενέργειας σε σχέση με το χρόνο λήφθηκαν δημιουργώντας έναν όγκο ενδιαφέροντος στην άνω περιοχή της ουροδόχου κύστης χρησιμοποιώντας ένα εργαλείο τρισδιάστατου περιγράμματος και μετρώντας τη δραστηριότητα (διορθωμένη αποσύνθεση) σε κιλομπεκερέλ ανά όργανο. Τα αποτελέσματα διορθώθηκαν με την εφαρμογή ενός παράγοντα βαθμονόμησης και στη συνέχεια κανονικοποιήθηκαν με όγκο όγκου που προήλθε από MRI.
Μελέτες ex vivo
Ιστοπαθολογικές αναλύσεις
Μετά την ολοκλήρωση όλων των απεικονίσεων, επιλεγμένες κύστεις (n = 3 ανά ομάδα) από ζώα που φέρουν όγκο και υγιή ζώα αφαιρέθηκαν σε άσηπτες συνθήκες και σταθεροποιήθηκαν αμέσως σε φορμαλδεΰδη 4%. Στη συνέχεια, οι κύστεις ενσωματώθηκαν σε παραφίνη πριν ληφθούν τομές 2–3 μm για χρώση αιματοξυλίνης-ηωσίνης. Λήφθηκαν αντιπροσωπευτικές εικόνες από όλες τις συνθήκες για ιστοπαθολογική εξέταση.
Ανάλυση ICP-MS
Οι μετρήσεις πραγματοποιήθηκαν σε Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) σε συνδυασμό με αυτόματο δειγματολήπτη ASX-560 (CETAC Tech). Μετά την ολοκλήρωση όλων των απεικονίσεων, τα ζώα θανατώθηκαν και επιλέχθηκαν οι κύστεις (n = 2 ανά ομάδα. τέσσερις ομάδες) συλλέχθηκαν και υποβλήθηκαν σε πέψη σε 1 ml HNO3:HCl (μίγμα 4:1). Η διασπορά έβρασε μέχρις ότου τα όργανα διαλύθηκαν πλήρως. Στη συνέχεια, το διάλυμα ψύχθηκε σε θερμοκρασία δωματίου και αναλύθηκε χρησιμοποιώντας ICP-MS για να προσδιοριστεί η συγκέντρωση του Au σε κάθε δείγμα, μετατρέποντας τα αποτελέσματα σε ποσοστά της δόσης που εγχύθηκε ανά γραμμάριο ιστού (%ID g-1).
Απεικόνιση ανοσοϊστοχημείας και ομοεστιακής μικροσκοπίας
Για αναλύσεις ανοσοϊστοχημείας, τα ζώα που φέρουν όγκο έλαβαν νανορομπότ με σήμανση FITC σε νερό ή 300 mM ουρίας (n = 4 ανά ομάδα), όπως περιγράφεται παραπάνω, για μελέτες PET-CT. Επιπλέον, ζώα που φέρουν όγκους χωρίς νανορομπότ χρησίμευσαν ως ομάδα ελέγχου (n = 2). Σε όλες τις περιπτώσεις, οι κύστεις συλλέχθηκαν, καταψύχθηκαν και κόπηκαν σε τμήματα 10 μm που στερεώθηκαν αμέσως σε φορμαλδεΰδη 10% για 15 λεπτά, πλύθηκαν με 10 mM PBS και στη συνέχεια επωάστηκαν σε 50 mM NH4Cl σε PBS για 5 min πριν ξεπλύνετε ξανά με PBS. Η διαπερατότητα πραγματοποιήθηκε με μεθανόλη:ακετόνη (1:1) για 5 λεπτά σε θερμοκρασία δωματίου και 0.1% Triton σε PBS για 5 λεπτά. Μετά την πλύση PBS, τα δείγματα κορέστηκαν με διάλυμα 5% BSA–0.5% Tween σε PBS για 15 λεπτά σε θερμοκρασία δωματίου και επωάστηκαν για 1 ώρα σε θερμοκρασία δωματίου με αντι-FITC ποντικού (1:100, Abcam) σε 5% BSA –0.5% Tween. Οι τομές πλύθηκαν τρεις φορές με 10 mM PBS για 5 λεπτά και επωάστηκαν για 30 λεπτά σε θερμοκρασία δωματίου με δευτερεύον αντίσωμα Alex Fluor 647 γαϊδουριού αντι-ποντικού IgG (Molecular Probes, Life Technologies, 1:1,000) σε 5% TSA-0.5%. σε PBS, πλύθηκε ξανά σε PBS (3 × 5 min) και τοποθετήθηκε με ένα κιτ κατά της εξασθένισης ProLong με 4,6-διαμιδινο-2-φαινυλινδόλη (DAPI; Molecular Probes, Life Technologies). Οι εικόνες ελήφθησαν με ομοεστιακό μικροσκόπιο Leica STELLARIS 5 (UPV/EHU Scientific Park) με πανομοιότυπες ρυθμίσεις για όλες τις τομές: μεγέθυνση ×10 με απεικόνιση πλακιδίων και ραφή (συνήθως οπτικό πεδίο 4 × 5). Η γραμμή λέιζερ και τα παράθυρα ανίχνευσης ήταν 405 nm και 440–503 nm για το DAPI, 489 nm και 494–602 nm για λευκό λέιζερ FITC και 653 nm και 660–836 nm για το λευκό laser Alexa.647
Οπτική εκκαθάριση
Μετά από έγχυση με 4% παραφορμαλδεΰδη και PBS, τα δείγματα της ουροδόχου κύστης αφαιρέθηκαν και σταθεροποιήθηκαν περαιτέρω σε 4% παραφορμαλδεΰδη όλη τη νύχτα στους 4 °C, στη συνέχεια ενσωματώθηκαν σε σύριγγα 5 ml με αγαρόζη 0.8% χαμηλού σημείου τήξης για να σχηματιστεί ένα κυλινδρικό μπλοκ και να καταστεί δυνατή η εύκολη τοποθέτηση στην κυβέτα χαλαζία. Ολόκληρο το μπλοκ αφυδατώθηκε προοδευτικά χρησιμοποιώντας μεθανόλη:Η2O στους 4 °C (30%:70% για 1 h, 50%:50% για 1 h, 70%:30% για 1 h, 100%:0% για 1 h, μετά 100% μεθανόλη όλη τη νύχτα και ξανά για 4 h) και τελικά βυθίζεται σε βενζυλική αλκοόλη-βενζοϊκό βενζύλιο (BABB) ως διάλυμα αντιστοίχισης δείκτη διάθλασης για απεικόνιση. Για in vitro συγκρίσεις πράσινων νανορομπότ FITC με εμπορικά κόκκινα σωματίδια, χρησιμοποιήσαμε νανοσωματίδια ερυθρού φθορίζοντος πυριτίου DiagNano (Creative Diagnostics), διαμέτρου 1 μm, ανθεκτικά στο καθαρισμό BABB.
Αυτοφθορισμός και πολωμένη απεικόνιση sLS
Η απεικόνιση σε φύλλο φωτός πραγματοποιήθηκε στο MacroSPIM, ένα προσαρμοσμένο σύστημα για καθαρή απεικόνιση ολόκληρων οργάνων που αναπτύχθηκε στο IRB Barcelona44,45. Εν συντομία, τα δείγματα ενσωματώνονται σε ένα μπλοκ αγαρόζης, καθαρίζονται μαζί με το δείγμα και απεικονίζονται μέσα σε μια κυψελίδα χαλαζία. Η απεικόνιση αυτοφθορισμού χρησιμοποίησε λέιζερ στα 488, 561 ή 638 nm παρέχοντας φωτισμό μέσω ενός αχρωματικού διπλού κυλινδρικού φακού 50 mm (ACY254-050-A, Thorlabs). Για να μειωθούν τα τεχνουργήματα λωρίδων, το φωτεινό φύλλο περιστρέφεται με έναν συντονιστικό σαρωτή SC-10 (EOPC) κατά μήκος ενός τηλεσκοπίου 4f με αχρωματικούς διπλούς φακούς G322288322 100 mm (QI Optic Photonics). Ο αυτοφθορισμός ιστού συλλέγεται μέσω φίλτρων φθορισμού ζώνης ή μακράς διέλευσης και καταγράφεται με κάμερα ORCA Flash v2 (Hamamatsu Photonics). Η απεικόνιση πραγματοποιήθηκε στο ×9.6 με zoom ×8, φακό ×2 και φακό σωλήνα ×0.6. Το φωτεινό φύλλο ισοπεδώθηκε σε όλο το οπτικό πεδίο, αποδίδοντας αξονική ανάλυση 5–6 μm. Η τρισδιάστατη απεικόνιση έγινε σε βήματα των 3 μm. Η απεικόνιση ολόκληρης της κύστης πραγματοποιήθηκε σε 2.5 × 2 ή 3 × 3 XY πλακάκια, ανάλογα με το μέγεθος του οργάνου.
Η απεικόνιση sLS επιτεύχθηκε αφαιρώντας το φίλτρο φθορισμού ή χρησιμοποιώντας οποιοδήποτε φίλτρο που εκπέμπει το λέιζερ. Η περιστροφή του φύλλου φωτός μειώνει τον θόρυβο κηλίδων λέιζερ, με αποτέλεσμα τον προσωρινό υπολογισμό του μέσου όρου της συνοχής του λέιζερ όπως φαίνεται νωρίτερα52. Ο προσανατολισμός της γραμμικής πόλωσης φύλλου φωτός στον φωτισμό ελεγχόταν περιστρέφοντας μια πλάκα μισού κύματος (AHWP05M-600, Thorlabs) πριν από τον περιστρεφόμενο σαρωτή. Το ανιχνευμένο σήμα επιλέχθηκε σε πόλωση χρησιμοποιώντας έναν περιστρεφόμενο γραμμικό πολωτή (LPVISC100, Thorlabs) πριν από τον τροχό φίλτρου στην ανίχνευση, εισάγοντας απώλεια έντασης >50% στην ανίχνευση φθορισμού. Ενώ η κατανομή του σήματος sLS γενικά αλλάζει με τον προσανατολισμό του πολωτή, το σήμα αυτοφθορισμού ιστού παραμένει ανεπηρέαστο από την περιστροφή του πολωτή. Το sLS αποδίδει χωρική ανάλυση 2.4 ± 0.3 μm σε BABB, η οποία είναι συγκρίσιμη με την ανάλυση στην απεικόνιση φωτός φθορισμού (που επιβεβαιώνεται με την προσαρμογή μιας συνάρτησης Gauss στο XY απόκριση εικόνας ενός μόνο σωματιδίου, Συμπληρωματικό Σχ. 8l–m) και κοντά στη θεωρητική ανάλυση στον αέρα (1.53 µm με αριθμητικό διάφραγμα (NA) = 0.2 σε μέγιστο ζουμ μακροεντολής ×8).
Επεξεργασία εικόνας και 3D ανάλυση
Η επεξεργασία εικόνας, η τμηματοποίηση και η ανάλυση των συνόλων δεδομένων ελαφρών φύλλων έγινε με ImageJ/Fiji, ενώ οι Εικ. 3 και 4 δημιουργήθηκαν με το Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) και Συμπληρωματικό Βίντεο 3 δημιουργήθηκε με το Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Τα σύνολα δεδομένων φωτιστικών φύλλων πλακιδίων συρράφθηκαν με το MosaicExplorerJ53. Η τρισδιάστατη τμηματοποίηση του ιστού της ουροδόχου κύστης πραγματοποιήθηκε με τη χρήση προσαρμοσμένων μακροεντολών ImageJ/Fiji για ημιαυτόματους σχολιασμούς 3D μεγάλων όγκων σε εικονική λειτουργία. Εν συντομία, ένα πρώτο σενάριο, το «Macro3», φορτώνει στοίβες τρισδιάστατων εικόνων, επιτρέπει τον σχολιασμό των ROI από τον χρήστη σε πολλά επίπεδα και παρεμβάλλει αυτόματα το ROI για τη δημιουργία και την εξαγωγή τρισδιάστατων μασκών. Τα ROI σχεδιάστηκαν κάθε 1 επίπεδα (κάθε 3 μm) για να διευκολυνθεί η καλή συνέχεια τμηματοποίησης, διατηρώντας παράλληλα τους σχολιασμούς στο εύλογο ελάχιστο. Ένα δεύτερο σενάριο, το «Macro3», εκτελεί τις μαθηματικές ή Boolean πράξεις, επίπεδο προς επίπεδο χωρίς να φορτώνει ολόκληρες τις στοίβες στη μνήμη, είτε μεταξύ τρισδιάστατων μασκών είτε μεταξύ μιας μάσκας 15D και των αρχικών δεδομένων, αποθηκεύοντας το αποτέλεσμα ως νέα στοίβα. Όλες οι μάσκες δημιουργήθηκαν με σχολιασμό εικόνων αυτοφθορισμού.
Τόσο τα επιφανειακά στρώματα όγκου όσο και υγιών ιστών (Εικ. 3) οριοθετήθηκαν χρησιμοποιώντας το ραβδί και τα εργαλεία λάσο των Φίτζι στην κοιλότητα της ουροδόχου κύστης σε μια μάσκα. Ονομάζοντας αυτήν την πρώτη επανάληψη BC1, οι επόμενες εκτελέσεις του Macro1 διαστέλλουν αυτόματα αυτό το περίγραμμα 3D κατά μια καθορισμένη ποσότητα pixel για να δώσουν νέες επαναλήψεις μάσκας, BC2, BC3 και ούτω καθεξής, με αυξανόμενες διαστολές. Το πρώτο στρώμα που περιέχει τόσο όγκο όσο και υγιή ιστό, η μάσκα L1, λαμβάνεται αφαιρώντας τη μάσκα BC1 από το BC2 και ούτω καθεξής, δίνοντας τα L2 και L3 ως ομόκεντρα στρώματα. Ο όγκος του όγκου που βρίσκεται πλησιέστερα στην κοιλότητα λήφθηκε με τον σχολιασμό του όγκου με εργαλεία ράβδου και λάσο για τη δημιουργία μιας μάσκας Τ1, ενώ το υγιές στρώμα 3D του ουροθηλίου ανιχνεύθηκε ξεχωριστά στη μάσκα U1. Αφαιρώντας το U1 από το L1 προκύπτει το επιφανειακό στρώμα του όγκου και ούτω καθεξής: L2 − U1, L3 − U1. Αντίστροφα, το πρώτο στρώμα του ουροθηλίου λαμβάνεται αφαιρώντας το T1 από το L1. Όλα τα στρώματα στο Σχ. 3 ορίστηκε ότι έχουν πάχος 33 μm.
Η ίδια σειρά μακροεντολών και διαδικασιών (εργαλείο ράβδου ImageJ, ψηφιακή διάβρωση 500 μm και ούτω καθεξής) χρησιμοποιήθηκαν για να οριοθετήσουν και να τμηματοποιήσουν το εσωτερικό μέρος του ιστού της ουροδόχου κύστης και στη συνέχεια να εκτιμήσουν τον εσωτερικό όγκο ιστού της κύστης (Εικ. 4, δείτε παραπάνω για λεπτομέρειες). Ιστογράμματα της έντασης του διασκορπισμένου σήματος δημιουργήθηκαν στα Φίτζι συνδυάζοντας το διάσπαρτο σήμα και τη μάσκα.
RNT χρησιμοποιώντας 131I-nanobots
Μεταξύ 8 και 15 ημερών μετά την εμφύτευση του όγκου, τα ζώα χωρίστηκαν σε έξι ομάδες (ομάδες 1-6), προσπαθώντας να επιτύχουν παρόμοιους μέσους όγκους όγκου μεταξύ των ομάδων (Πίνακας 2). Για τα πειράματα, τα ζώα προκλήθηκαν με αναισθησία (5% ισοφλουράνιο σε καθαρό Ο2) και τοποθετήστε σε ύπτια θέση πριν αδειάσετε την κύστη κάνοντας μασάζ στην περιοχή της κοιλιάς. Αμέσως μετά, 100 μl της κατάλληλης θεραπείας σε συγκέντρωση 400 μg ml-1 (Τραπέζι 2) ενστάλαξε στην ουροδόχο κύστη χρησιμοποιώντας καθετήρα 24 μετρητών. Η θεραπεία και το όχημα (νερό ή ουρία) παρέμειναν στην ουροδόχο κύστη για 1 ώρα πριν την αφαίρεση του καθετήρα. Η ουροδόχος κύστη άδειασε ξανά με κοιλιακό μασάζ και τα ποντίκια συνήλθαν από την αναισθησία στα κλουβιά τους, αντικαθιστώντας το πριονίδι του ζωικού κλουβιού 24 ώρες μετά τη θεραπεία για την απομάκρυνση της ραδιενεργής μόλυνσης.
Η θεραπευτική αποτελεσματικότητα προσδιορίζεται με μαγνητική τομογραφία
Πραγματοποιήθηκαν δύο μελέτες μαγνητικής τομογραφίας σε κάθε ποντίκι: (1) μεταξύ των ημερών 7 και 14 μετά τον εμβολιασμό του όγκου για να τυχαιοποιηθούν τα ζώα μεταξύ των ομάδων και να μετρηθούν οι αρχικοί όγκοι όγκου (προ της θεραπείας). (2) μεταξύ των ημερών 16 και 21 μετά τον εμβολιασμό του όγκου (μετά τη θεραπεία) για την αξιολόγηση της θεραπευτικής αποτελεσματικότητας. Η μαγνητική τομογραφία πραγματοποιήθηκε με χρήση σαρωτών 7 T Bruker BioSpec και 11.7 T Bruker BioSpec (και οι δύο με λογισμικό ParaVision 7), ανάλογα με τη διαθεσιμότητα. Αυτό δεν επηρέασε τα αποτελέσματα αφού το εξωτερικό πεδίο δεν είναι κρίσιμο για την ανατομική απεικόνιση14. Πειράματα απεικόνισης διεξήχθησαν χρησιμοποιώντας τις ίδιες παραμέτρους απεικόνισης και επεξεργασία όπως εξηγήθηκε παραπάνω (Παρακολούθηση μεγέθους όγκου). Στην περίπτωση του σαρωτή 11.7 T, η ρύθμιση αποτελούνταν από ένα πηνίο επιφάνειας καρδιάς ποντικιού για τη λήψη και ένα ογκομετρικό πηνίο για μετάδοση. Οι όγκοι του όγκου σε κάθε φέτα προσδιορίστηκαν από όγκους ενδιαφέροντος που σχεδιάστηκαν με το χέρι και καλύπτουν την περιοχή του όγκου.
Στατιστική ανάλυση
Σε μελέτες απεικόνισης PET, τα ποσοστά της ενέσιμης δόσης (% ID) και της ενέσιμης δόσης ανά όγκο όγκου (% ID cm-3) συγκρίθηκαν χρησιμοποιώντας μονόδρομη ANOVA. Οι διαφορές μεταξύ των ομάδων προσδιορίστηκαν χρησιμοποιώντας το τεστ πολλαπλών συγκρίσεων του Tukey. Το NTV στο τμήμα RNT ελήφθη από ένα t-τεστ μη ζευγαρωμένων τιμών. Η κατανομή δεδομένων θεωρήθηκε κανονική, αλλά αυτό δεν δοκιμάστηκε επίσημα. Πραγματοποιήθηκαν στατιστικές αναλύσεις με GraphPad Prism v.8.
Περίληψη αναφοράς
Περισσότερες πληροφορίες σχετικά με τον σχεδιασμό της έρευνας διατίθενται στο Σύνοψη αναφοράς χαρτοφυλακίου Nature που συνδέονται με αυτό το άρθρο.
- SEO Powered Content & PR Distribution. Ενισχύστε σήμερα.
- PlatoData.Network Vertical Generative Ai. Ενδυναμώστε τον εαυτό σας. Πρόσβαση εδώ.
- PlatoAiStream. Web3 Intelligence. Ενισχύθηκε η γνώση. Πρόσβαση εδώ.
- PlatoESG. Ανθρακας, Cleantech, Ενέργεια, Περιβάλλον, Ηλιακός, Διαχείριση των αποβλήτων. Πρόσβαση εδώ.
- PlatoHealth. Ευφυΐα βιοτεχνολογίας και κλινικών δοκιμών. Πρόσβαση εδώ.
- πηγή: https://www.nature.com/articles/s41565-023-01577-y
- :είναι
- :δεν
- ][Π
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2009
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 7
- 70
- 8
- 9
- 900
- 95%
- a
- Σχετικα
- πάνω από
- συμφωνία
- συσσώρευση
- Κατορθώνω
- επιτευχθεί
- αποκτήθηκαν
- απόκτηση
- απόκτηση
- απέναντι
- ενεργοποιείται
- ενεργός
- δραστηριότητα
- προστιθέμενη
- προσθήκη
- Επιπλέον
- διαχείριση
- επηρεάζουν
- Μετά το
- κατόπιν
- πάλι
- Απευθύνεται
- ΑΕΡΑ
- AL
- alex
- αλγόριθμος
- Όλα
- επιτρέπεται
- κατά μήκος
- Αλτσχάιμερ
- μεταξύ των
- ποσό
- αμυλοειδές
- an
- αναλύσεις
- ανάλυση
- Άγκυρα
- και
- ζώο
- αγελάδων
- αντίσωμα
- κάθε
- εφαρμογές
- εφαρμοσμένος
- εφαρμόζοντας
- κατάλληλος
- εγκεκριμένη
- aqua
- ΕΙΝΑΙ
- ΠΕΡΙΟΧΗ
- άρθρο
- AS
- υποτίθεται
- παραδοχές
- At
- Αρχές
- αυτομάτως
- διαθεσιμότητα
- διαθέσιμος
- μέσος
- κατά μέσο όρο
- b
- BABB
- εύρος ζώνης
- βάση
- BE
- πριν
- συμπεριφορά
- είναι
- παρακάτω
- μεταξύ
- Αποκλεισμός
- σώμα
- βρασμένος
- και οι δύο
- Εγκέφαλος
- βάρος
- αλλά
- by
- κλουβιά
- υπολογίζεται
- κλήση
- φωτογραφική μηχανή
- ΚΑΡΚΙΝΟΣ
- περίπτωση
- περιπτώσεις
- CCD
- κύτταρο
- Κύτταρα
- Αλλαγές
- χρέωση
- χημική ουσία
- Ξέφωτο
- κλικ
- Κλινικός
- Κλεισιμο
- Πλησιέστερα
- σπείρα
- συλλέγονται
- συνδυασμός
- συνδυάζοντας
- εμπορικός
- επιτροπή
- συγκρίσιμος
- σύγκριση
- συγκρίσεις
- εντελώς
- ολοκληρώνοντας
- συγκέντρωση
- κατάσταση
- Συνθήκες
- διενεργούνται
- εμπιστοσύνη
- ΕΠΙΒΕΒΑΙΩΜΕΝΟΣ
- συνεχής
- συνέχεια
- συνεχώς
- έλεγχος
- ελέγχεται
- αντίστροφως
- Δροσερός
- Διορθώθηκε
- Διορθώσεις
- Αντίστοιχος
- Συμβούλιο
- σε συνδυασμό
- κάλυμμα
- δημιουργία
- δημιουργήθηκε
- δημιουργία
- Δημιουργικός
- κριτήρια
- κρίσιμης
- CT σαρώνει
- έθιμο
- Τομή
- σκοτάδι
- ημερομηνία
- σύνολα δεδομένων
- ημέρα
- Ημ.
- de
- ορίζεται
- παράδοση
- Σε συνάρτηση
- περιγράφεται
- Υπηρεσίες
- επιθυμητή
- καθέκαστα
- εντοπιστεί
- Ανίχνευση
- Προσδιορίστε
- αποφασισμένος
- καθορίζοντας
- αναπτύχθηκε
- συσκευή
- Διαγνωστικά
- DID
- διαφορά
- διαφορές
- διαφορετικές
- Διάχυση
- ψηφιακό
- αραιωμένο
- κατεύθυνση
- Νόσος
- πιάτο
- Διασπορά
- διανομή
- Διανομές
- διαιρούμενο
- do
- κάνει
- γίνεται
- δόση
- που
- Πτώση
- διάρκεια
- δυναμικός
- δυναμική
- e
- Ε & Τ
- κάθε
- εύκολος
- ηχώ
- αποτελεσματικότητα
- είτε
- ενσωματωμένο
- ενεργοποιήσετε
- δίνει τη δυνατότητα
- Τελικό σημείο
- ενισχυμένη
- Ολόκληρος
- ενζυματική
- εξοπλισμένο
- εγκατεστημένος
- εγκατάσταση
- εκτίμηση
- Αιθέρας (ΕΤΗ)
- δεοντολογία
- ευρωπαϊκός
- αξιολογήσει
- Κάθε
- εξέταση
- υπέρβαση
- Εκτός
- προσδοκία
- αναμένεται
- πείραμα
- πειραματικός
- πειράματα
- εξήγησε
- εξαγωγή
- εξωτερικός
- διευκολύνω
- παράγοντας
- θηλυκός
- πεδίο
- Σύκο
- Εικόνα
- γεμάτο
- φιλτράρισμα
- Φίλτρα
- τελικός
- Τελικά
- Όνομα
- προσαρμογή
- καθορίζεται
- φλας
- ακολουθείται
- Εξής
- Για
- μορφή
- φορμαλδευγή
- Επίσημα
- Εμπρός
- τέσσερα
- από
- παγωμένος
- λειτουργία
- περαιτέρω
- χάσμα
- ge
- GE Healthcare
- General
- παράγουν
- παράγεται
- Δίνοντας
- καλός
- κλίσεις
- Γραμμάριο
- Πράσινο
- Group
- Ομάδα
- Ανάπτυξη
- κατευθυντήριων γραμμών
- Χειρίζεται
- Έχω
- he
- Υγεία
- υγειονομική περίθαλψη
- διαιτιτικο
- Καρδιά
- HTTPS
- huang
- ανθρώπινος
- icap
- ID
- identiques
- if
- εικόνα
- ανάλυση εικόνας
- εικόνες
- Απεικόνιση
- αμέσως
- βυθισμένος
- βελτιώνει
- in
- περιλαμβάνονται
- ενσωματώνοντας
- αύξηση
- επωάζονται
- Επώαση
- ΕΠΩΑΣΗ
- ανεξάρτητος
- ευρετήριο
- επαγωγή
- πληροφορίες
- αρχικός
- μέσα
- μέσων
- ενσωματωθεί
- διαδραστικό
- τόκος
- εσωτερικός
- σε
- εισάγοντας
- επανάληψη
- επαναλήψεις
- ΤΟΥ
- Επέκταση KDA
- τήρηση
- κιτ
- l2
- large
- λέιζερ
- λέιζερ
- στρώμα
- στρώματα
- αφήνοντας
- αριστερά
- Φακός
- φακούς
- ζωή
- φως
- γραμμή
- LINK
- συνδέονται
- φόρτωση
- φορτία
- τοπικός
- off
- Macro
- μακροεντολές
- διατηρήσουν
- διατηρηθεί
- συντήρηση
- χειροκίνητα
- μάσκα
- Masks
- ταιριάζουν
- υλικό
- υλικά
- μαθηματικός
- Μήτρα
- ανώτατο όριο
- μέσα
- μέτρο
- μετράται
- μετρήσεις
- μέτρησης
- Εικόνες / Βίντεο
- Μνήμη
- μερινό
- Μεθανόλη
- μέθοδοι
- ποντίκια
- Μικροσκόπιο
- Μικροσκοπία
- πρακτικά
- ελάχιστο
- ανήλικος
- μικτός
- μίγμα
- ML
- Κινητό
- Τρόπος
- μοντέλο
- μοντέλα
- τροποποιημένο
- ενότητα
- μοριακός
- παρακολούθηση
- παρακολούθηση
- κίνηση
- ποντίκι
- MRI
- MS
- MT
- πολλαπλούς
- νανοτεχνολογία
- Φύση
- δίκτυα
- Ουδέτερος
- Νέα
- Όχι.
- Θόρυβος
- κανονικός
- αριθμητικός
- σκοπός
- παρατηρούμενη
- αποκτήσει
- λαμβάνεται
- of
- Παλιά
- on
- ONE
- λειτουργίας
- επιχειρήσεων
- λειτουργίες
- οπτικός
- βελτιστοποιημένη
- or
- Orca
- πρωτότυπο
- επί
- διανυκτέρευση
- Οξφόρδη
- Οξυγόνο
- Χαρτί
- παράμετροι
- Πάρκο
- μέρος
- σωματίδιο
- PBS
- πάσσαλος
- διείσδυση
- για
- ποσοστά
- εκτελούνται
- εκτελεί
- κατοικίδιο ζώο
- Petri
- φάσεις
- άξονας περιστροφής
- Εικονοκύτταρο
- τοποθετούνται
- αεροπλάνο
- Αεροπλάνα
- Πλάτων
- Πληροφορία δεδομένων Plato
- Πλάτωνα δεδομένα
- Σημείο
- σημεία
- χαρτοφυλάκιο
- θέση
- τοποθετημένες
- Ακρίβεια
- έτοιμος
- παρόν
- προηγουμένως
- διαδικασία
- διαδικασίες
- μεταποίηση
- προοδευτικά
- πρωτόκολλο
- Qi
- ποσοτικός
- Ραδιόφωνο
- τυχαίος
- Τυχαία
- ΑΡΟΥΡΑΙΟΣ
- Τιμή
- αναλογία
- Αντίδραση
- αντιδρώντας
- αντίδραση
- Αναγνώστης
- λογικός
- λόγους
- έλαβε
- υποδοχή
- καταγράφονται
- Ανάκτηση
- Red
- μείωση
- Μειωμένος
- μειώνει
- αναφορά
- περιοχή
- παρέμεινε
- λείψανα
- αφαιρέστε
- Καταργήθηκε
- αφαίρεση
- αναφέρθηκαν
- Αναφορά
- εκπρόσωπος
- απαιτείται
- έρευνα
- ανθεκτικός
- Ανάλυση
- απάντησης
- αποτέλεσμα
- με αποτέλεσμα
- Αποτελέσματα
- ρομπότ
- Δωμάτιο
- τρέχει
- s
- SA
- ίδιο
- οικονομία
- σαρώσεις
- διεσπαρμένος
- SCI
- επιστημονικός
- γραφή
- Δεύτερος
- δευτερεύων
- Τμήμα
- τμήματα
- δείτε
- τμήμα
- κατάτμηση
- επιλέγονται
- χωριστά
- Ακολουθία
- σερβίρεται
- ρυθμίσεις
- διάφοροι
- σεντόνι
- παρουσιάζεται
- Σήμα
- Κατανομή σήματος
- παρόμοιες
- αφού
- ενιαίας
- ΕΞΙ
- Μέγεθος
- Φέτα
- small
- So
- νάτριο
- λογισμικό
- λύση
- Λύσεις
- χωρική
- σταθερότητα
- σωρός
- Στοίβες
- στατικός
- στατιστικός
- stellaris
- Βήματα
- αποθηκεύονται
- ρίγα
- Φοιτητής
- μελέτες
- μεταγενέστερος
- Ακολούθως
- σουίτα
- Επιφάνεια
- Συμπτώματα
- σύνθεση
- σύστημα
- T
- T1
- τραπέζι
- λήψη
- tech
- Τεχνολογίες
- τηλεσκόπιο
- πρότυπο
- δέκα
- δοκιμή
- δοκιμαστεί
- ότι
- Η
- τους
- Τους
- τότε
- θεωρητικός
- Θεραπευτικός
- θεραπεία
- αυτό
- διεξοδικά
- εκείνοι
- τρία
- τρισδιάστατος
- Μέσω
- παντού
- ώρα
- φορές
- ιστός
- προς την
- μαζι
- εργαλείο
- εργαλεία
- Σύνολο
- προς
- προς
- μετασχηματίζοντας
- θεραπεία
- Τρίτωνος
- προσπαθώντας
- όγκοι
- δύο
- τύπος
- συνήθως
- ανεπηρέαστος
- υπό
- μέχρι
- επάνω σε
- μεταχειρισμένος
- Χρήστες
- χρησιμοποιώντας
- Αξίες
- όχημα
- Εναντίον
- μέσω
- Βίντεο
- Βίντεο
- Δες
- Πραγματικός
- φαντάζομαι
- vivo
- τόμος
- όγκους
- ογκομετρικοό
- περιπατητής
- ράβδος
- ήταν
- πλύσιμο
- Νερό
- we
- Εβδ.
- βάρος
- Ευημερία
- ήταν
- Τροχός
- Ποιό
- ενώ
- άσπρο
- παράθυρα
- με
- εντός
- χωρίς
- X
- Βελτιστοποίηση
- αποδίδοντας
- αποδόσεις
- zephyrnet
- ζουμ