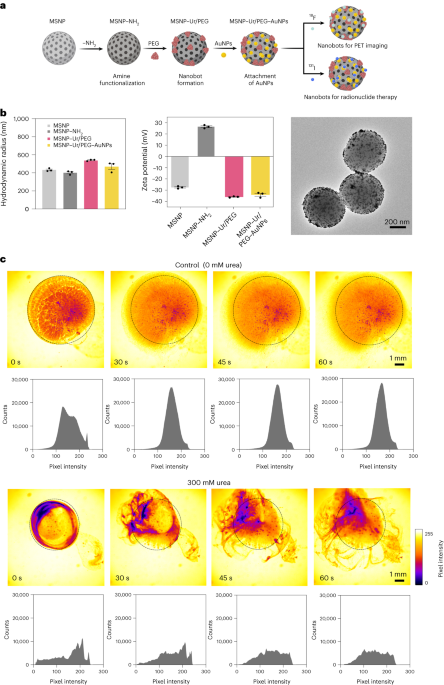
Sintesis nanobot
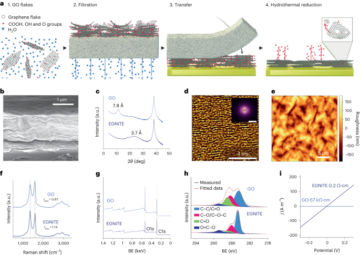
Nanobots disiapkan seperti yang dijelaskan sebelumnya33. Singkatnya, MSNP disintesis menggunakan metode Stöber yang dimodifikasi41, mereaksikan trietanolamin (35 g), air ultra murni (20 ml) dan heksadesiltrimetilamonium bromida (CTAB; 570 mg) pada 95 °C selama 30 menit sambil diaduk. Tetraetil ortosilikat (1.5 ml) kemudian ditambahkan tetes demi tetes; campuran dibiarkan bereaksi selama 2 jam pada suhu 95 °C dan MSNP yang dihasilkan dikumpulkan dengan sentrifugasi dan dicuci dalam etanol (tiga kali, 2,500g, 5 menit). Untuk menghilangkan templat CTAB, MSNP ditempatkan di bawah refluks dalam metanol asam (1.8 ml HCl, 30 ml metanol) selama 24 jam. Kemudian, MSNP dikumpulkan dengan sentrifugasi dan dicuci tiga kali dalam etanol (2,500g, 5 menit) sebelum memasukkan modifikasi amina dengan menambahkan APTES (6 µl per mg MSNP) ke MSNPs (1 mg ml-1) dalam larutan etanol 70% pada suhu 70 °C, diaduk kuat-kuat selama 1 jam. MSNP-NH2 dikumpulkan dan dicuci tiga kali dalam etanol dan tiga kali dalam air dengan sentrifugasi (tiga kali, 1,150g, 5 menit). MSNP-NH2 diresuspensi dalam PBS pada konsentrasi 1 mg ml-1 dan volume total 900 µl, dan diaktivasi dengan glutaraldehid (100 µl) selama 2.5 jam pada suhu kamar. MSNPs-NH yang diaktifkan2 dikumpulkan dan dicuci dalam PBS tiga kali dengan sentrifugasi (1,150g, 5 menit), diresuspensi dalam larutan urease (3 mg ml-1) dan PEG heterobifungsional (1 μg PEG per mg 5 kDa HS-MSNPs-NH2) dalam PBS, dan bereaksi selama 24 jam pada suhu kamar. Nanobot yang dihasilkan kemudian dikumpulkan dan dicuci tiga kali dalam PBS dengan sentrifugasi (1,150g, 5 menit) sebelum disuspensikan kembali dalam dispersi AuNP, yang disiapkan seperti dijelaskan sebelumnya51, biarkan bereaksi selama 10 menit, dan cuci bersih dengan sentrifugasi (tiga kali, 1,150g, 5 menit).
Distribusi ukuran hidrodinamik dan muatan permukaan MSNPs, MSNPs-NH2, nanobots dan nanobots yang dihiasi AuNP ditentukan masing-masing menggunakan sistem hamburan cahaya dinamis Wyatt Mobius dan Malvern Zetasizer. Dalam semua kasus, konsentrasinya adalah 20 µg ml-1 dan waktu akuisisi 5 s, menggunakan tiga proses per eksperimen. Tiga pengukuran per jenis partikel dilakukan.
Sintesis MSNP FITC
Campuran FITC (2 mg), etanol (5 ml) dan APTES (400 µl) disiapkan dan diaduk selama 30 menit. Kemudian, protokol yang dijelaskan sebelumnya untuk sintesis MSNP diikuti, kecuali bahwa kami menambahkan tetraetil ortosilikat (1.25 ml) tetes demi tetes dalam kombinasi dengan campuran FITC-APTES (250 µl). Langkah-langkah fungsionalisasi untuk mendapatkan nanobot berlabel FITC adalah seperti yang disebutkan di atas.
Sintesis AuNP
AuNP disintesis menggunakan metode yang dilaporkan33. Singkatnya, semua bahan dibersihkan menggunakan aqua regia yang baru disiapkan, dibilas dengan air, dan dikeringkan di udara. Selanjutnya, AuCl 1 mM4 larutan dipanaskan sampai titik didihnya sambil diaduk dalam labu alas bulat yang diintegrasikan ke dalam sistem refluks. Setelah itu, 10 ml larutan natrium sitrat (30.8 mM) ditambahkan, dan larutan dididihkan selama 20 menit, menghasilkan warna merah. Larutan kemudian dibiarkan dingin hingga suhu kamar sambil diaduk selama 1 jam. AuNP yang dihasilkan disimpan dalam gelap dan karakterisasi dilakukan menggunakan mikroskop elektron transmisi.
Aktivitas enzimatik
Aktivitas enzimatik nanobot, 18F-nanobot dan 131I-nanobots diukur menggunakan fenol merah. Untuk melakukannya, 2 µl nanobots (1 mg ml-1) ditambahkan ke pelat 96 sumur dan dicampur dengan 200 µl larutan urea berbeda (0, 50, 100, 200 mM) dalam 1.1 mM fenol merah. Absorbansi pada 560 nm diukur seiring waktu pada 37 °C.
Dinamika gerak nanobot melalui mikroskop optik
Video optik nanobot diperoleh menggunakan mikroskop Leica Thunder, ditambah dengan kamera CCD berkecepatan tinggi Hamamatsu dan objektif ×1.25. Untuk ini, nanobot disentrifugasi dan diresuspensi dalam 50 µl PBS (konsentrasi akhir 20 mg ml-1). Kemudian, cawan Petri diisi dengan 3 ml PBS atau larutan urea 300 mM (dalam PBS) dan diamati di bawah mikroskop. Setetes 5 µl dengan nanobots (20 mg ml-1) kemudian ditambahkan ke cawan Petri berisi cairan dan video direkam dengan kecepatan 25 frame per detik. Distribusi intensitas piksel video dalam ROI dianalisis pada interval 15 detik menggunakan perangkat lunak ImageJ.
Pelabelan radio nanobot dengan [18F]F-PyTFP
Sintesis dari [18F]F-PyTFP
[18F]F-PyTFP disintesis dalam modul Neptis xSeed (Aplikasi Radiokimia yang Dioptimalkan), mengikuti metode yang dilaporkan sebelumnya33.
Sintesis 18nanobot berlabel F
Nanobot diberi label dengan [18F]F-PyTFP, berdasarkan prosedur yang telah ditetapkan sebelumnya dengan sedikit modifikasi33. Singkatnya, 200 µl larutan nanobot (1 mg ml-1) disentrifugasi (10 menit, 13,853g), diresuspensi dalam 10 µl PBS (1 mM, pH 8), dan diinkubasi dengan 4 µl [18F]F-PyTFP dalam asetonitril (sekitar 37 MBq) selama 35 menit pada suhu kamar. Setelah inkubasi, campuran reaksi diencerkan dengan air (200 µl) dan dimurnikan dengan sentrifugasi (5 menit, 13,853g). Pelet yang dihasilkan kemudian dibilas tiga kali dengan air sebelum diukur dalam kalibrator dosis (CPCRC-25R, Capintec). Hasil radiokimia dihitung sebagai rasio antara jumlah radioaktivitas yang ada di nanobot setelah pencucian dan jumlah radioaktivitas awal. Kemurnian radiokimia setelah pemurnian adalah ≥99%, sebagaimana ditentukan oleh kromatografi lapis tipis radio (radio-TLC) menggunakan kertas kromatografi iTLC-SG (Agilent Technologies) dan diklorometana dan metanol (2:1) masing-masing sebagai fase diam dan fase gerak. Pelat TLC dianalisis menggunakan pembaca TLC (MiniGITA, Raytest).
Stabilitas 18F-nanobot
Stabilitas dari 18Nanobot berlabel F ditentukan menggunakan media berikut: (1) 300 mM urea, (2) air, dan (3) urin dari hewan pembawa tumor. 18Nanobot berlabel F (10 µl) diinkubasi dengan larutan yang sesuai (100 µl) selama 1 jam pada suhu kamar. Kemudian, nanobot dan supernatan dipisahkan dengan sentrifugasi dan dikumpulkan, dan radioaktivitas diukur dalam kalibrator dosis (CPCRC-25R).
Pelabelan radio pada nanobot dengan 131I
Radioiodinasi nanobot urease dilakukan dengan menginkubasi nanobot dengan injeksi [131I]larutan NaI (925 MBq ml-1; GE Kesehatan). Singkatnya, 400 µl larutan nanobot urease (1 mg ml-1) disentrifugasi (13,853g, 5 menit), diresuspensi dalam 100 µl PBS (10 mM, pH 7.4) dan diinkubasi dengan 25 µl atau 185 µl injeksi [131I]NaI (masing-masing sekitar 42.55 atau 277.5 MBq) selama 30 menit, bergantung pada aktivitas akhir yang diinginkan. Setelah inkubasi, campuran reaksi dimurnikan dengan sentrifugasi (13,853g, 5 menit). Endapan yang dihasilkan dicuci tiga kali dengan air (100 µl). Radioaktivitas dalam supernatan dan endapan ditentukan menggunakan kalibrator dosis (CPCRC-25R), dan kedua fraksi dianalisis dengan radio-TLC, adapun 18F-nanobot.
Pengembangan model hewan
Tikus dipelihara dan ditangani sesuai dengan Petunjuk Dewan Eropa 2010/63/UE dan pedoman internal. Semua prosedur eksperimental telah disetujui oleh komite etika biomaGUNE CIC dan otoritas lokal (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Analisis gambar (PET dan MRI) tidak mengetahui distribusi kelompok hewan.
Model murine ortotopik kanker kandung kemih dihasilkan oleh pemberian sel MB49 intravesika (garis sel kandung kemih karsinoma murine) ke tikus betina C57BL/6JRj (berusia 8 minggu, Janvier). Untuk percobaan yang bertujuan menentukan akumulasi tumor (empat kelompok; rincian di bawah), enam hewan diinokulasi per kelompok, sebagaimana ditentukan menggunakan analisis presisi, dengan asumsi berikut: presisi yang diperlukan, 20%; s.d. yang diharapkan, ±20%; kepercayaan diri, 95%; kehilangan hewan, 20%. Untuk percobaan kemanjuran terapeutik (enam kelompok; rincian di bawah), sepuluh hewan dimasukkan per kelompok, yang dihitung menggunakan Student satu sisi t-uji, perbedaan antara dua mean independen, dengan asumsi sebagai berikut: hipotesis nol, pengobatan tidak mempengaruhi pertumbuhan tumor; α, 0.05; 1 − β, 0.95; sd, ±50%; perbedaan yang diharapkan antar kelompok, 50%; kehilangan hewan, 20%. Karena percobaan dilakukan dalam dua kelompok untuk alasan operasional, satu kelompok kontrol dimasukkan dalam kedua kelompok (Tabel 2), lalu semua hewan dikumpulkan. Untuk pembentukan tumor, tikus dibius dengan menghirup isofluran 3% dalam O murni2 dan dipertahankan oleh 1.0–1.5% isofluran dalam 100% O2. Kemudian, kandung kemih dikosongkan, dan lesi kimia diinduksi pada urothelium dengan memasukkan 50 µl poli-l-lisin (Sigma-Aldrich) melalui kateter 24 gauge selama 15 menit. Selanjutnya, kandung kemih dikosongkan lagi dan sel MB49 (105 sel) dalam DMEM glukosa tinggi (100 µl) ditanamkan selama 1 jam sebelum melepas kateter dan mengosongkan kandung kemih melalui pijat perut. Sepanjang percobaan, tikus dipantau dan ditimbang untuk pemantauan kesehatan dan kesejahteraan. Titik akhir pada manusia diterapkan jika penurunan berat badan melebihi 20% atau berdasarkan gejala klinis, berdasarkan kriteria dokter hewan yang bertanggung jawab.
Pelacakan ukuran tumor
Studi MRI dilakukan 7 dan 14 hari setelah induksi tumor, menggunakan pemindai 7 T Bruker BioSpec USR 70/30 (Bruker BioSpin) yang dilengkapi dengan sisipan gradien BGA-12S berukuran 440 mT m-1 dan resonator QSN 112/086 (T12053V3) untuk frekuensi radio14 transmisi, dan kumparan permukaan otak tikus (T11205V3) untuk penerimaan RF (keduanya beroperasi pada 300 MHz). Hewan dibius dengan isofluran (4% untuk induksi dan 1.5% untuk pemeliharaan dalam larutan O 50%).2/50% N2 campuran) dan ditempatkan pada dudukan yang kompatibel dengan MR. Suhu tubuh dan laju pernapasan terus dipantau menggunakan perangkat pemantauan yang kompatibel dengan MR (model 1030 SA, Small Animal Instruments), dihubungkan ke sistem pemanas udara hewan pengerat kecil untuk menjaga suhu tubuh. Setelah memperoleh gambar referensi, rangkaian pencitraan berbobot difusi berbasis spin-echo digunakan untuk menggambarkan tumor, menggunakan parameter berikut: waktu gema (TE) = 22.3 ms, waktu pengulangan (TR) = 2,500 ms, n = 2 rata-rata, satu gambar A0 (gambar basal dengan b = 0 detik mm-2) dan satu gambar DW diperoleh menggunakan gradien difusi pada arah (1, 0, 0) dengan durasi gradien δ = 4.5 ms dan pemisahan gradien Δ = 10.6 ms, memberi b = 650 detik mm-2, 16 × 16 mm2 bidang pandang, ukuran matriks gambar 160 × 160 poin, 20 irisan berturut-turut dengan ketebalan 0.5 mm (tanpa celah, diperoleh dalam mode interleaved) dan bandwidth 192.9 Hz per piksel. Untuk memvisualisasikan tumor, gambar diproses ulang dengan perangkat lunak ImageJ, membagi gambar yang diperoleh dengan gradien difusi (b = 650 detik mm-2) oleh mereka yang diperoleh tanpa (b = 0 detik mm-2), dan menerapkan filter Gaussian 3D (σx = σy = σz = 0.7) terhadap hasilnya. Tumor digambarkan secara manual untuk menentukan volumenya.
Biodistribusi in vivo
Pada hari ke 15 setelah induksi tumor, tikus diacak menjadi empat kelompok untuk mendapatkan distribusi volume tumor rata-rata yang homogen antar kelompok. Pemindaian PET-CT (pemindai MOLECUBES β dan X-CUBE) diperoleh 3 jam setelah pemberian 100 µl intravesika 18F-BSA (grup 1 dan 2) atau 18F-urease (kelompok 3 dan 4) nanobot pada konsentrasi 200 µg ml-1, menggunakan air (kelompok 1 dan 3) atau 300 mM urea dalam air (kelompok 2 dan 4) sebagai pembawa (Tabel 1). Untuk akuisisi gambar, hewan diinduksi dengan anestesi (isofluran 5% dalam oksigen murni) dan ditempatkan dalam posisi terlentang sebelum memijat daerah perut untuk evakuasi kandung kemih. Segera setelah itu, yang sesuai 18nanobot berlabel F (18F-BSA/18F-urease dalam air/urea) ditanamkan ke dalam kandung kemih melalui kateter ukuran 24 dan diinkubasi selama 1 jam, sebelum melepaskan kateter, mengosongkan kandung kemih dan membiarkan tikus pulih dari anestesi. Pada t = 3 jam setelah pemberian, hewan dibius ulang dan gambar PET seluruh tubuh statis diperoleh selama 10 menit, diikuti dengan CT scan. Gambar PET direkonstruksi menggunakan algoritma rekonstruksi maksimalisasi ekspektasi subset terurut 3D dengan koreksi acak, sebar, dan atenuasi. Gambar PET-CT dari tikus yang sama didaftarkan bersama dan dianalisis menggunakan alat pemrosesan gambar PMOD. Plot konsentrasi radioaktivitas versus waktu diperoleh dengan membuat volume yang menarik di daerah kandung kemih bagian atas menggunakan alat kontur 3D dan mengukur aktivitas (koreksi peluruhan) dalam kilobecquerel per organ. Hasilnya dikoreksi dengan menerapkan faktor kalibrasi dan kemudian dinormalisasi dengan volume tumor yang diturunkan dari MRI.
Studi ex vivo
Analisis histopatologis
Setelah menyelesaikan semua pencitraan, kandung kemih yang dipilih (n = 3 per kelompok) dari hewan yang mengandung tumor dan sehat dikeluarkan dalam kondisi aseptik dan segera difiksasi dalam formaldehida 4%. Kemudian, kandung kemih ditanam dalam parafin sebelum mengambil bagian 2–3 µm untuk pewarnaan hematoksilin-eosin. Gambar representatif diperoleh dari semua kondisi untuk pemeriksaan histopatologis.
Analisis ICP-MS
Pengukuran dilakukan pada Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) yang digabungkan dengan autosampler ASX-560 (CETAC Tech). Setelah menyelesaikan semua pencitraan, hewan dibunuh, dan kandung kemih dipilih (n = 2 per grup; empat kelompok) dikumpulkan dan dicerna dalam 1 ml HNO3:HCl (campuran 4:1). Dispersinya direbus sampai organnya larut sempurna. Kemudian, larutan didinginkan hingga suhu kamar dan dianalisis menggunakan ICP-MS untuk menentukan konsentrasi Au dalam setiap sampel, mengubah hasilnya menjadi persentase dosis yang disuntikkan per gram jaringan (%ID g-1).
Pencitraan imunohistokimia dan mikroskop confocal
Untuk analisis imunohistokimia, hewan pembawa tumor menerima nanobot berlabel FITC dalam air atau 300 mM urea (n = 4 per kelompok), seperti dijelaskan di atas, untuk studi PET-CT. Selain itu, hewan pembawa tumor tanpa nanobot berperan sebagai kelompok kontrol (n = 2). Dalam semua kasus, kandung kemih dikumpulkan, dibekukan dan dipotong menjadi bagian berukuran 10 µm yang segera difiksasi dalam formaldehida 10% selama 15 menit, dicuci dengan 10 mM PBS dan kemudian diinkubasi dalam 50 mM NH4Cl dalam PBS selama 5 menit sebelum dibilas kembali dengan PBS. Permeabilisasi dilakukan dengan metanol:aseton (1:1) selama 5 menit pada suhu kamar dan 0.1% Triton dalam PBS selama 5 menit. Setelah pencucian PBS, sampel dijenuhkan dengan larutan 5% BSA-0.5% Tween dalam PBS selama 15 menit pada suhu kamar dan diinkubasi selama 1 jam pada suhu kamar dengan anti-FITC tikus (1:100, Abcam) dalam 5% BSA –0.5% Dua belas. Bagian dicuci tiga kali dengan 10 mM PBS selama 5 menit dan diinkubasi selama 30 menit pada suhu kamar dengan antibodi sekunder Alex Fluor 647 keledai anti-tikus IgG (Molecular Probe, Life Technologies, 1:1,000) dalam 5% BSA–0.5% Tween dalam PBS, dicuci lagi dalam PBS (3 × 5 mnt) dan dipasang dengan kit antifade ProLong dengan 4,6-diamidino-2-phenylindole (DAPI; Molecular Probe, Life Technologies). Gambar diperoleh dengan mikroskop confocal Leica STELLARIS 5 (UPV/EHU Scientific Park) dengan pengaturan yang identik untuk semua bagian: pembesaran ×10 dengan pencitraan dan penjahitan ubin (biasanya bidang pandang 4 × 5). Garis laser dan jendela deteksi adalah 405 nm dan 440–503 nm untuk DAPI, 489 nm dan 494–602 nm untuk laser putih FITC dan 653 nm dan 660–836 nm untuk laser putih Alexa647.
Kliring optik
Setelah perfusi dengan paraformaldehyde 4% dan PBS, sampel kandung kemih dikeluarkan dan selanjutnya difiksasi dalam paraformaldehyde 4% semalaman pada suhu 4 °C, kemudian ditanam dalam jarum suntik 5 ml dengan agarosa titik leleh rendah 0.8% untuk membentuk blok silinder dan memungkinkan mudah dipasang di kuvet kuarsa. Seluruh blok didehidrasi secara progresif menggunakan metanol:H2O pada 4 °C (30%:70% selama 1 jam, 50%:50% selama 1 jam, 70%:30% selama 1 jam, 100%:0% selama 1 jam, lalu 100% metanol semalaman dan sekali lagi untuk 4 h) dan terakhir direndam dalam benzil alkohol-benzil benzoat (BABB) sebagai larutan pencocokan indeks bias untuk pencitraan. Untuk perbandingan in vitro nanobot FITC hijau dengan partikel merah komersial, kami menggunakan nanopartikel silika fluoresen merah DiagNano (Diagnostik Kreatif), diameter 1 µm, tahan terhadap pembersihan BABB.
Autofluoresensi dan pencitraan sLS terpolarisasi
Pencitraan lembaran cahaya dilakukan pada MacroSPIM, sistem khusus untuk pencitraan seluruh organ yang dikembangkan di IRB Barcelona44,45. Singkatnya, sampel dimasukkan ke dalam blok agarosa, dibersihkan bersama sampel, dan dicitrakan di dalam kuvet kuarsa. Pencitraan autofluoresensi menggunakan laser pada 488, 561 atau 638 nm yang memberikan penerangan melalui lensa silinder doublet akromatik 50 mm (ACY254-050-A, Thorlabs). Untuk mengurangi artefak garis, lembaran cahaya diputar dengan pemindai resonansi SC-10 (EOPC) di sepanjang teleskop 4f dengan lensa doublet akromatik G322288322 100 mm (QI Optic Photonics). Autofluoresensi jaringan dikumpulkan melalui filter fluoresensi pita atau panjang dan direkam dengan kamera ORCA Flash v2 (Hamamatsu Photonics). Pencitraan dilakukan pada ×9.6 dengan zoom ×8, lensa ×2, dan lensa tabung ×0.6. Lembaran cahaya diratakan melintasi bidang pandang, menghasilkan resolusi aksial 5–6 µm. Pencitraan 3D dilakukan dalam langkah 2.5 µm. Pencitraan seluruh kandung kemih dilakukan dalam 2 × 3 atau 3 × 4 XY ubin, tergantung pada ukuran organ.
Pencitraan sLS dicapai dengan menghilangkan filter fluoresensi atau menggunakan filter apa pun yang mentransmisikan laser. Perputaran lembaran cahaya mengurangi kebisingan bintik laser, menghasilkan rata-rata koherensi laser sementara seperti yang ditunjukkan sebelumnya52. Orientasi polarisasi lembaran cahaya linier dalam iluminasi dikontrol dengan memutar pelat setengah gelombang (AHWP05M-600, Thorlabs) sebelum pemindai pivot. Sinyal yang terdeteksi dipilih dalam polarisasi menggunakan polarizer linier berputar (LPVISC100, Thorlabs) sebelum roda filter dideteksi, menyebabkan hilangnya intensitas >50% dalam deteksi fluoresensi. Meskipun distribusi sinyal sLS secara umum berubah seiring dengan orientasi polarizer, sinyal autofluoresensi jaringan tetap tidak terpengaruh oleh rotasi polarizer. sLS menghasilkan resolusi spasial 2.4 ± 0.3 µm di BABB, yang sebanding dengan resolusi dalam pencitraan lembaran cahaya fluoresensi (dikonfirmasi dengan memasangkan fungsi Gaussian ke XY respon gambar dari satu partikel, Gambar Tambahan. 8l–m) dan mendekati resolusi teoretis di udara (1.53 µm dengan bukaan numerik (NA) = 0.2 pada zoom makro maksimum ×8).
Pemrosesan gambar dan analisis 3D
Pemrosesan gambar, segmentasi dan analisis kumpulan data light-sheet dilakukan dengan ImageJ/Fiji, sedangkan Gambar. 3 dan 4 dihasilkan dengan Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) dan Video Tambahan 3 dihasilkan dengan Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Instrumen Oxford). Kumpulan data ubin ringan dijahit dengan MosesExplorerJ53. Segmentasi 3D jaringan kandung kemih dilakukan menggunakan makro ImageJ/Fiji khusus untuk anotasi 3D semi-otomatis volume besar dalam mode virtual. Singkatnya, skrip pertama, 'Macro1', memuat tumpukan gambar 3D, memungkinkan anotasi pengguna terhadap ROI di beberapa bidang dan secara otomatis menginterpolasi ROI untuk menghasilkan dan mengekspor masker 3D. ROI diambil setiap 15 bidang (setiap 37.5 µm) untuk memfasilitasi kesinambungan segmentasi yang baik sekaligus menjaga anotasi pada tingkat minimum yang wajar. Skrip kedua, 'Macro2', melakukan operasi matematika atau Boolean, bidang demi bidang tanpa memuat seluruh tumpukan ke dalam memori, baik antara masker 3D atau antara masker 3D dan data asli, menyimpan hasilnya sebagai tumpukan baru. Semua topeng dihasilkan dengan memberi anotasi pada gambar autofluoresensi.
Lapisan permukaan tumor dan jaringan sehat (Gbr. 2). 3) digambarkan menggunakan tongkat Fiji dan alat laso pada rongga kandung kemih dalam masker. Memanggil iterasi pertama ini BC1, selanjutnya menjalankan Macro1 kemudian secara otomatis melebarkan kontur 3D ini dengan jumlah piksel yang ditentukan untuk menghasilkan iterasi mask baru, BC2, BC3 dan seterusnya, dengan dilatasi yang semakin meningkat. Lapisan pertama yang mengandung tumor dan jaringan sehat, masker L1, diperoleh dengan mengurangkan masker BC1 dari BC2 dan seterusnya, menghasilkan L2 dan L3 sebagai lapisan konsentris. Volume tumor yang paling dekat dengan rongga diperoleh dengan menganotasi tumor menggunakan tongkat dan alat laso untuk membuat masker T1, sedangkan lapisan urothelium 3D yang sehat dideteksi secara terpisah ke dalam masker U1. Mengurangi U1 dari L1 menghasilkan lapisan permukaan tumor, dan seterusnya: L2 − U1, L3 − U1. Sebaliknya, lapisan pertama urothelium diperoleh dengan mengurangkan T1 dari L1. Semua lapisan pada Gambar. 3 didefinisikan memiliki ketebalan 33 µm.
Rangkaian makro dan prosedur yang sama (alat tongkat ImageJ, erosi digital 500 µm, dan seterusnya) digunakan untuk menggambarkan dan mensegmentasi bagian dalam jaringan kandung kemih dan kemudian memperkirakan volume jaringan internal kandung kemih (Gbr. XNUMX). 4, lihat di atas untuk detailnya). Histogram intensitas sinyal tersebar dibuat di Fiji dengan menggabungkan sinyal tersebar dan topeng.
RNT menggunakan 131Aku-nanobot
Antara hari ke 8 dan 15 setelah implantasi tumor, hewan dibagi menjadi enam kelompok (kelompok 1-6), mencoba untuk mencapai rata-rata volume tumor yang sama di seluruh kelompok (Tabel 2). Untuk percobaan, hewan diinduksi dengan anestesi (isofluran 5% dalam O murni).2) dan diposisikan terlentang sebelum mengosongkan kandung kemih dengan cara memijat daerah perut. Segera setelah itu, 100 µl pengobatan yang sesuai pada konsentrasi 400 µg ml-1 (Meja 2) dimasukkan ke dalam kandung kemih menggunakan kateter ukuran 24. Perawatan dan pembawa (air atau urea) tetap berada di kandung kemih selama 1 jam sebelum melepas kateter. Kandung kemih dikosongkan lagi dengan pijatan perut dan tikus pulih dari anestesi di kandangnya, mengganti serbuk gergaji kandang hewan 24 jam setelah perawatan untuk menghilangkan kontaminasi radioaktif.
Kemanjuran terapeutik ditentukan oleh MRI
Dua penelitian MRI dilakukan pada masing-masing tikus: (1) antara hari ke 7 dan 14 setelah inokulasi tumor untuk mengacak hewan antar kelompok dan mengukur volume tumor awal (pra-perawatan); (2) antara hari ke 16 dan 21 setelah inokulasi tumor (pasca pengobatan) untuk mengevaluasi kemanjuran terapi. MRI dilakukan menggunakan pemindai 7 T Bruker BioSpec dan 11.7 T Bruker BioSpec (keduanya dengan perangkat lunak ParaVision 7), tergantung ketersediaan. Hal ini tidak mempengaruhi hasil karena bidang eksternal tidak penting untuk pencitraan anatomi14. Eksperimen pencitraan dilakukan menggunakan parameter dan pemrosesan pencitraan yang sama seperti dijelaskan di atas (Pelacakan ukuran tumor). Dalam kasus pemindai 11.7 T, pengaturannya terdiri dari kumparan permukaan jantung mouse untuk penerimaan dan kumparan volumetrik untuk transmisi. Volume tumor di setiap irisan ditentukan dari volume yang diambil secara manual yang menutupi area tumor.
Analisis statistik
Dalam studi pencitraan PET, persentase dosis yang disuntikkan (% ID) dan dosis yang disuntikkan per volume tumor (% ID cm-3) dibandingkan menggunakan ANOVA satu arah. Perbedaan antar kelompok ditentukan dengan menggunakan uji perbandingan berganda Tukey. NTV di bagian RNT diperoleh dari a t-uji nilai yang tidak berpasangan. Distribusi data diasumsikan normal, namun hal ini tidak diuji secara formal. Analisis statistik dilakukan dengan GraphPad Prism v.8.
Ringkasan pelaporan
Informasi lebih lanjut tentang desain penelitian tersedia di Ringkasan Pelaporan Portofolio Alam tertaut ke artikel ini.
- Konten Bertenaga SEO & Distribusi PR. Dapatkan Amplifikasi Hari Ini.
- PlatoData.Jaringan Vertikal Generatif Ai. Berdayakan Diri Anda. Akses Di Sini.
- PlatoAiStream. Intelijen Web3. Pengetahuan Diperkuat. Akses Di Sini.
- PlatoESG. Karbon, teknologi bersih, energi, Lingkungan Hidup, Tenaga surya, Penanganan limbah. Akses Di Sini.
- PlatoHealth. Kecerdasan Uji Coba Biotek dan Klinis. Akses Di Sini.
- Sumber: https://www.nature.com/articles/s41565-023-01577-y
- :adalah
- :bukan
- ][P
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2009
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 7
- 70
- 8
- 9
- 900
- 95%
- a
- Tentang Kami
- atas
- sesuai
- akumulasi
- Mencapai
- dicapai
- diperoleh
- mengakuisisi
- perolehan
- di seluruh
- diaktifkan
- aktif
- kegiatan
- menambahkan
- menambahkan
- Selain itu
- administrasi
- mempengaruhi
- Setelah
- setelah itu
- lagi
- ditujukan
- UDARA
- AL
- alex
- algoritma
- Semua
- diizinkan
- sepanjang
- Alzheimer
- antara
- jumlah
- amyloid
- an
- analisis
- analisis
- Jangkar
- dan
- hewan
- hewan
- antibodi
- Apa pun
- aplikasi
- terapan
- Menerapkan
- sesuai
- disetujui
- aqua
- ADALAH
- DAERAH
- artikel
- AS
- diasumsikan
- asumsi
- At
- Pihak berwenang
- secara otomatis
- tersedianya
- tersedia
- rata-rata
- rata-rata
- b
- BABB
- Bandwidth
- dasar
- BE
- sebelum
- laku
- makhluk
- di bawah
- antara
- Memblokir
- tubuh
- rebus
- kedua
- Otak
- beban
- tapi
- by
- kandang
- dihitung
- panggilan
- kamar
- Kanker
- kasus
- kasus
- CCD
- sel
- Sel
- Perubahan
- biaya
- kimia
- Pembukaan hutan
- Klik
- Klinis
- Penyelesaian
- paling dekat
- gulungan
- dikumpulkan
- kombinasi
- menggabungkan
- komersial
- komite
- sebanding
- dibandingkan
- perbandingan
- sama sekali
- menyelesaikan
- konsentrasi
- kondisi
- Kondisi
- dilakukan
- kepercayaan
- DIKONFIRMASI
- berturut-turut
- kontinuitas
- terus menerus
- kontrol
- dikendalikan
- sebaliknya
- dingin
- dikoreksi
- Koreksi
- Sesuai
- Dewan
- ditambah
- penutup
- membuat
- dibuat
- membuat
- Kreatif
- kriteria
- kritis
- CT scan
- adat
- Memotong
- gelap
- data
- kumpulan data
- hari
- Hari
- de
- didefinisikan
- mengantarkan
- Tergantung
- dijelaskan
- Mendesain
- diinginkan
- rincian
- terdeteksi
- Deteksi
- Menentukan
- ditentukan
- menentukan
- dikembangkan
- alat
- Diagnostik
- MELAKUKAN
- perbedaan
- perbedaan
- berbeda
- Difusi
- digital
- diencerkan
- arah
- Penyakit
- hidangan
- Penyebaran
- distribusi
- distribusi
- Terbagi
- do
- tidak
- dilakukan
- dosis
- ditarik
- Menjatuhkan
- lamanya
- dinamis
- dinamika
- e
- E&T
- setiap
- Mudah
- gema
- kemanjuran
- antara
- tertanam
- aktif
- memungkinkan
- Titik akhir
- ditingkatkan
- Seluruh
- enzimatik
- lengkap
- mapan
- pembentukan
- memperkirakan
- Eter (ETH)
- etika
- Eropa
- mengevaluasi
- Setiap
- pemeriksaan
- melampaui
- Kecuali
- harapan
- diharapkan
- eksperimen
- eksperimental
- eksperimen
- menjelaskan
- ekspor
- luar
- memudahkan
- faktor
- wanita
- bidang
- Ara
- Angka
- terisi
- menyaring
- filter
- terakhir
- Akhirnya
- Pertama
- sesuai
- tetap
- flash
- diikuti
- berikut
- Untuk
- bentuk
- formaldehida
- Secara formal
- sebagainya
- empat
- dari
- beku
- fungsi
- lebih lanjut
- celah
- ge
- GE Healthcare
- Umum
- menghasilkan
- dihasilkan
- Pemberian
- baik
- gradien
- Gram
- Hijau
- Kelompok
- Grup
- Pertumbuhan
- pedoman
- ditangani
- Memiliki
- he
- Kesehatan
- kesehatan
- sehat
- Hati
- HTTPS
- huang
- manusia
- icap
- ID
- identik
- if
- gambar
- analisis gambar
- gambar
- Pencitraan
- segera
- terbenam
- meningkatkan
- in
- termasuk
- menggabungkan
- meningkatkan
- diinkubasi
- Inkubasi
- INKUBASI
- independen
- indeks
- induksi
- informasi
- mulanya
- dalam
- instrumen
- terpadu
- interaktif
- bunga
- intern
- ke
- memperkenalkan
- perulangan
- iterasi
- NYA
- KDA
- pemeliharaan
- kit
- l2
- besar
- laser
- laser
- lapisan
- lapisan
- meninggalkan
- meninggalkan
- lensa
- lensa
- Hidup
- cahaya
- baris
- LINK
- terkait
- pemuatan
- beban
- lokal
- lepas
- Makro
- Macro
- memelihara
- dipertahankan
- pemeliharaan
- manual
- masker
- masker
- sesuai
- bahan
- bahan
- matematis
- Matriks
- maksimum
- cara
- mengukur
- diukur
- pengukuran
- ukur
- Media
- Memori
- merino
- Metanol
- metode
- tikus
- Mikroskop
- Mikroskopi
- menit
- minimum
- minor
- campur aduk
- campuran
- ML
- mobil
- mode
- model
- model
- dimodifikasi
- modul
- molekuler
- dipantau
- pemantauan
- gerakan
- mouse
- MRI
- MS
- MT
- beberapa
- нанотехнологии
- Alam
- jaringan
- Netral
- New
- tidak
- Kebisingan
- normal
- numerik
- tujuan
- diamati
- memperoleh
- diperoleh
- of
- Tua
- on
- ONE
- operasi
- operasional
- Operasi
- optik
- dioptimalkan
- or
- Orca
- asli
- lebih
- semalam
- Oxford
- Oksigen
- kertas
- parameter
- Taman
- bagian
- partikel
- PBS
- Pasak
- penetrasi
- untuk
- Persentase
- dilakukan
- melakukan
- kesayangan
- Petri
- fase
- Poros
- pixel
- ditempatkan
- pesawat
- Pesawat
- plato
- Kecerdasan Data Plato
- Data Plato
- Titik
- poin
- portofolio
- posisi
- diposisikan
- Ketelitian
- siap
- menyajikan
- sebelumnya
- Prosedur
- Prosedur
- pengolahan
- secara bertahap
- protokol
- Qi
- kuantitatif
- radio
- acak
- Acak
- TIKUS
- Penilaian
- perbandingan
- Bereaksi
- bereaksi
- reaksi
- Pembaca
- masuk akal
- alasan
- diterima
- penerimaan
- tercatat
- Memulihkan
- Merah
- menurunkan
- mengurangi
- mengurangi
- referensi
- wilayah
- tetap
- sisa
- menghapus
- Dihapus
- menghapus
- Dilaporkan
- Pelaporan
- wakil
- wajib
- penelitian
- tahan
- Resolusi
- tanggapan
- mengakibatkan
- dihasilkan
- Hasil
- robot
- Kamar
- berjalan
- s
- SA
- sama
- penghematan
- scan
- tersebar
- SCI
- ilmiah
- naskah
- Kedua
- sekunder
- Bagian
- bagian
- melihat
- ruas
- segmentasi
- terpilih
- terpisah
- Urutan
- yang telah dilayani
- pengaturan
- beberapa
- lembar
- ditunjukkan
- Sinyal
- Distribusi sinyal
- mirip
- sejak
- tunggal
- ENAM
- Ukuran
- Iris
- kecil
- So
- sodium
- Perangkat lunak
- larutan
- Solusi
- spasial
- Stabilitas
- tumpukan
- Tumpukan
- statis
- statistik
- stellaris
- Tangga
- tersimpan
- garis
- mahasiswa
- studi
- selanjutnya
- Kemudian
- rangkaian
- Permukaan
- Gejala
- perpaduan
- sistem
- T
- T1
- tabel
- pengambilan
- tech
- Teknologi
- teleskop
- Template
- sepuluh
- uji
- diuji
- bahwa
- Grafik
- mereka
- Mereka
- kemudian
- teoretis
- Terapeutik
- terapi
- ini
- sepenuhnya
- itu
- tiga
- tiga dimensi
- Melalui
- di seluruh
- waktu
- kali
- tisu
- untuk
- bersama
- alat
- alat
- Total
- terhadap
- terhadap
- mengubah
- pengobatan
- Pelaut
- mencoba
- tumor
- dua
- mengetik
- khas
- tidak terpengaruh
- bawah
- sampai
- atas
- bekas
- Pengguna
- menggunakan
- Nilai - Nilai
- kendaraan
- Lawan
- melalui
- Video
- Video
- View
- maya
- membayangkan
- vivo
- volume
- volume
- volumetrik
- pejalan
- tongkat sihir
- adalah
- pencucian
- air
- we
- minggu
- berat
- kesejahteraan
- adalah
- Roda
- yang
- sementara
- putih
- Windows
- dengan
- dalam
- tanpa
- X
- Menghasilkan
- penurut
- hasil panen
- zephyrnet.dll
- zoom