12 tháng 2023, XNUMX (Tin tức Nanowerk) Bất chấp vai trò cơ bản của nó trong sinh học và các nghiên cứu sâu rộng trong hơn nửa thế kỷ, nhiều khía cạnh về cách hình thành các khối xây dựng của DNA vẫn chưa rõ ràng. Giờ đây, một nhóm các nhà khoa học quốc tế đã tiết lộ những chi tiết có giá trị về quá trình phức tạp này. Nghiên cứu được công bố trên Khoa học (“Cấu trúc của gốc protein ribonucleotide reductase R2”), cung cấp những hiểu biết sâu sắc về enzyme gốc – một phân tử có khả năng phản ứng cao khởi đầu quá trình tổng hợp DNA – và có thể mở đường cho các ứng dụng y tế và điều trị ung thư và các bệnh truyền nhiễm. Nhóm nghiên cứu bao gồm các nhà nghiên cứu từ Đại học Stockholm, CNRS-Đại học Toulouse, Phòng thí nghiệm Máy gia tốc Quốc gia SLAC của Bộ Năng lượng và Phòng thí nghiệm Quốc gia Lawrence Berkeley cùng một số tổ chức khác đã kết hợp chuyên môn của họ để giải đáp những bí ẩn về ribonucleotide reductase (RNR), một cơ chế độc nhất vô nhị. tập hợp các enzyme tạo ra các khối xây dựng DNA.
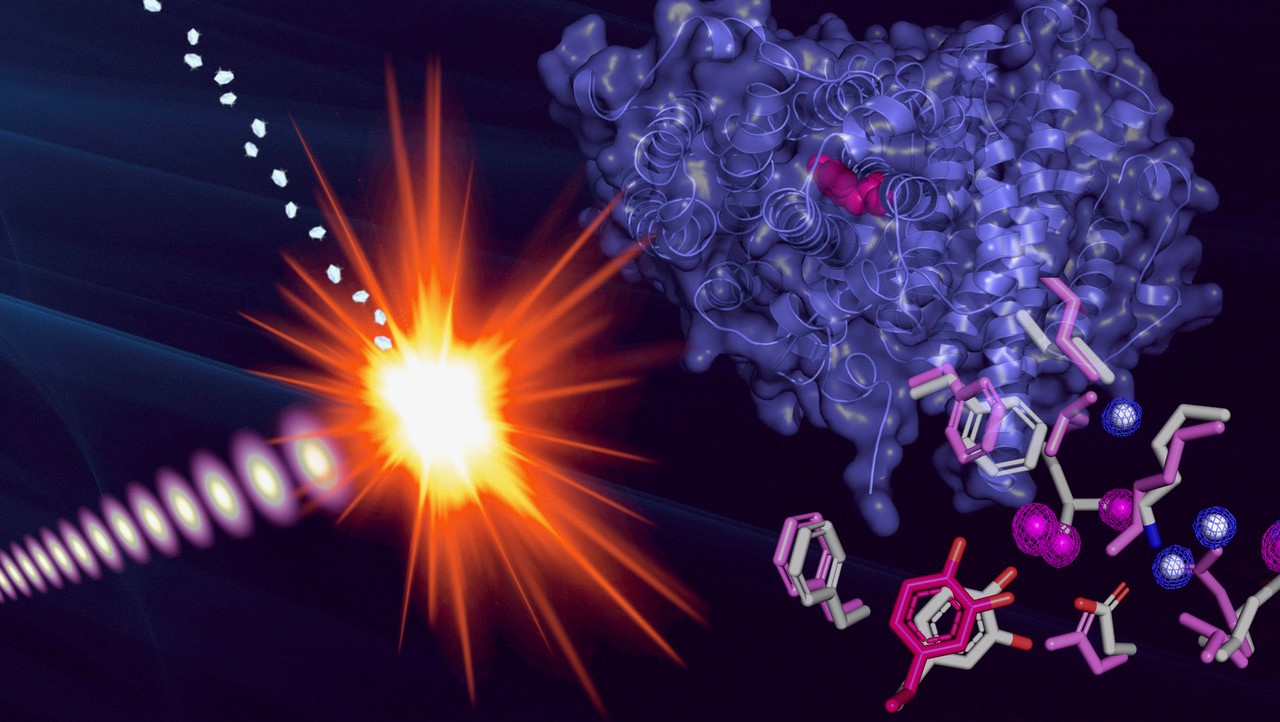 Cấu trúc của gốc protein được xác định bằng cách cho các vi tinh thể của protein gốc tiếp xúc với các xung cực ngắn và cường độ mạnh từ tia laser X. (Ảnh: Martin Högbom, Đại học Stockholm) RNR đã khiến các nhà khoa học bối rối trong nhiều thập kỷ. Chúng tạo ra các gốc tự do, là một loại phân tử có thể gây tổn hại cho tế bào nhưng cũng rất cần thiết cho một số quá trình sinh hóa. Giải quyết bí ẩn của RNR nằm ở việc tìm hiểu trạng thái gốc hoạt động của chúng, một hiện tượng dường như nghịch lý được phát hiện lần đầu tiên cách đây 50 năm, trong đó protein bản thân là gốc và do đó có số electron lẻ.
Martin Högbom, nhà nghiên cứu tại Đại học Stockholm, người đứng đầu nghiên cứu, cho biết: “Có nền tảng về hóa học, tôi rất ngạc nhiên khi biết rằng enzyme sử dụng các gốc tự do”. “Vào thời điểm đó, ý tưởng xác định xem gốc protein trông như thế nào thậm chí còn xa vời về mặt lý thuyết. Nhưng sự tò mò này đã theo tôi suốt sự nghiệp khoa học của mình.” Trong những năm qua, nhiều hệ thống enzyme đã được công nhận sử dụng hóa học gốc, nhưng cho đến nay người ta vẫn chưa thể quan sát cấu trúc của protein ở trạng thái phản ứng này do tính nhạy cảm vốn có của chúng đối với việc đo lường.
“Chúng tôi sử dụng tia X để đo cấu trúc của protein, nhưng các gốc tự do cực kỳ nhạy cảm với tổn thương bức xạ do các chùm tia X này gây ra”. Nhà khoa học và cộng tác viên SLAC Roberto Alonso-Mori cho biết. “Tia X có thể tạo ra nhiều electron và các gốc khác có thể vô hiệu hóa trạng thái gốc protein mà chúng tôi muốn nghiên cứu.” Sử dụng tia X-quang Linac Coherent Light Source (LCLS) của SLAC, nhóm nghiên cứu đã sử dụng một kỹ thuật tiên tiến gọi là tinh thể học femto giây nối tiếp, cho phép các nhà nghiên cứu quan sát protein và các phân tử khác ở nhiệt độ mà chúng được tìm thấy trong tự nhiên, kết hợp với nhiễu xạ trước khi phá hủy, cho phép các nhà nghiên cứu thu thập thông tin chính xác từ các mẫu tinh tế ngay lập tức trước khi chúng bị tia laser thổi bay. Điều này cho phép họ lần đầu tiên chụp được hình ảnh của protein ở trạng thái gốc hoạt động, cung cấp cái nhìn sâu sắc trực tiếp về cách thức hoạt động của nó khi hoạt động.
Ngoài ý nghĩa nền tảng trong sinh học, phát hiện này còn có tiềm năng điều trị vì RNR rất cần thiết cho quá trình phân chia tế bào.
Cộng tác viên Jan Kern, một nhà khoa học tại Phòng thí nghiệm quốc gia Lawrence Berkeley. cho biết: “Với phương pháp mới này, chúng tôi có thể hiểu được cách kiểm soát và sử dụng tự nhiên các trạng thái phản ứng này, mang lại những tiến bộ tiềm năng trong phương pháp điều trị, đặc biệt là đối với các tình trạng như ung thư”. Để theo dõi, các nhà nghiên cứu hy vọng sẽ mở rộng nghiên cứu của họ sang các dạng khác của enzyme này.
Cộng tác viên Hugo Lebrette, cựu nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm và hiện là trưởng nhóm nghiên cứu tại Đại học CNRS-Toulouse, cho biết: “Chúng tôi mong muốn nghiên cứu các loại ribonucleotide reductase khác, mở rộng hiểu biết của chúng tôi về sự hình thành gốc tự do ở các loại enzyme khác nhau”.
Cộng tác viên Vivek Srinivas, nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm cho biết thêm: “So sánh những điều này có thể cung cấp cái nhìn sâu sắc về việc nhắm mục tiêu các enzyme cụ thể trong các sinh vật có liên quan”. Điều này sẽ mở ra cơ hội quan sát các protein khác nhau ở dạng hoạt động của chúng, với hy vọng rằng điều này có thể định hình lại việc điều trị bệnh. phương pháp.” Mặc dù việc thu thập dữ liệu được thực hiện trong vòng một giờ nhưng nền tảng cho cột mốc quan trọng này đã được đặt trong nhiều thập kỷ, được đánh dấu bằng nền tảng tỉ mỉ, xác định các hệ thống mô hình phù hợp và chuẩn bị mẫu.
Högbom nói: “Niềm đam mê của tôi với các gốc protein đã bắt đầu cách đây gần 30 năm trong quá trình học đại học của tôi. “Khái niệm về enzyme tạo ra và duy trì gốc tự do là một khám phá. Mục tiêu của chúng tôi là hiểu rõ họ protein này và mỗi thí nghiệm, mỗi bài báo sẽ đưa chúng tôi đến gần hơn với mục tiêu đó.
Cấu trúc của gốc protein được xác định bằng cách cho các vi tinh thể của protein gốc tiếp xúc với các xung cực ngắn và cường độ mạnh từ tia laser X. (Ảnh: Martin Högbom, Đại học Stockholm) RNR đã khiến các nhà khoa học bối rối trong nhiều thập kỷ. Chúng tạo ra các gốc tự do, là một loại phân tử có thể gây tổn hại cho tế bào nhưng cũng rất cần thiết cho một số quá trình sinh hóa. Giải quyết bí ẩn của RNR nằm ở việc tìm hiểu trạng thái gốc hoạt động của chúng, một hiện tượng dường như nghịch lý được phát hiện lần đầu tiên cách đây 50 năm, trong đó protein bản thân là gốc và do đó có số electron lẻ.
Martin Högbom, nhà nghiên cứu tại Đại học Stockholm, người đứng đầu nghiên cứu, cho biết: “Có nền tảng về hóa học, tôi rất ngạc nhiên khi biết rằng enzyme sử dụng các gốc tự do”. “Vào thời điểm đó, ý tưởng xác định xem gốc protein trông như thế nào thậm chí còn xa vời về mặt lý thuyết. Nhưng sự tò mò này đã theo tôi suốt sự nghiệp khoa học của mình.” Trong những năm qua, nhiều hệ thống enzyme đã được công nhận sử dụng hóa học gốc, nhưng cho đến nay người ta vẫn chưa thể quan sát cấu trúc của protein ở trạng thái phản ứng này do tính nhạy cảm vốn có của chúng đối với việc đo lường.
“Chúng tôi sử dụng tia X để đo cấu trúc của protein, nhưng các gốc tự do cực kỳ nhạy cảm với tổn thương bức xạ do các chùm tia X này gây ra”. Nhà khoa học và cộng tác viên SLAC Roberto Alonso-Mori cho biết. “Tia X có thể tạo ra nhiều electron và các gốc khác có thể vô hiệu hóa trạng thái gốc protein mà chúng tôi muốn nghiên cứu.” Sử dụng tia X-quang Linac Coherent Light Source (LCLS) của SLAC, nhóm nghiên cứu đã sử dụng một kỹ thuật tiên tiến gọi là tinh thể học femto giây nối tiếp, cho phép các nhà nghiên cứu quan sát protein và các phân tử khác ở nhiệt độ mà chúng được tìm thấy trong tự nhiên, kết hợp với nhiễu xạ trước khi phá hủy, cho phép các nhà nghiên cứu thu thập thông tin chính xác từ các mẫu tinh tế ngay lập tức trước khi chúng bị tia laser thổi bay. Điều này cho phép họ lần đầu tiên chụp được hình ảnh của protein ở trạng thái gốc hoạt động, cung cấp cái nhìn sâu sắc trực tiếp về cách thức hoạt động của nó khi hoạt động.
Ngoài ý nghĩa nền tảng trong sinh học, phát hiện này còn có tiềm năng điều trị vì RNR rất cần thiết cho quá trình phân chia tế bào.
Cộng tác viên Jan Kern, một nhà khoa học tại Phòng thí nghiệm quốc gia Lawrence Berkeley. cho biết: “Với phương pháp mới này, chúng tôi có thể hiểu được cách kiểm soát và sử dụng tự nhiên các trạng thái phản ứng này, mang lại những tiến bộ tiềm năng trong phương pháp điều trị, đặc biệt là đối với các tình trạng như ung thư”. Để theo dõi, các nhà nghiên cứu hy vọng sẽ mở rộng nghiên cứu của họ sang các dạng khác của enzyme này.
Cộng tác viên Hugo Lebrette, cựu nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm và hiện là trưởng nhóm nghiên cứu tại Đại học CNRS-Toulouse, cho biết: “Chúng tôi mong muốn nghiên cứu các loại ribonucleotide reductase khác, mở rộng hiểu biết của chúng tôi về sự hình thành gốc tự do ở các loại enzyme khác nhau”.
Cộng tác viên Vivek Srinivas, nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm cho biết thêm: “So sánh những điều này có thể cung cấp cái nhìn sâu sắc về việc nhắm mục tiêu các enzyme cụ thể trong các sinh vật có liên quan”. Điều này sẽ mở ra cơ hội quan sát các protein khác nhau ở dạng hoạt động của chúng, với hy vọng rằng điều này có thể định hình lại việc điều trị bệnh. phương pháp.” Mặc dù việc thu thập dữ liệu được thực hiện trong vòng một giờ nhưng nền tảng cho cột mốc quan trọng này đã được đặt trong nhiều thập kỷ, được đánh dấu bằng nền tảng tỉ mỉ, xác định các hệ thống mô hình phù hợp và chuẩn bị mẫu.
Högbom nói: “Niềm đam mê của tôi với các gốc protein đã bắt đầu cách đây gần 30 năm trong quá trình học đại học của tôi. “Khái niệm về enzyme tạo ra và duy trì gốc tự do là một khám phá. Mục tiêu của chúng tôi là hiểu rõ họ protein này và mỗi thí nghiệm, mỗi bài báo sẽ đưa chúng tôi đến gần hơn với mục tiêu đó.
 Cấu trúc của gốc protein được xác định bằng cách cho các vi tinh thể của protein gốc tiếp xúc với các xung cực ngắn và cường độ mạnh từ tia laser X. (Ảnh: Martin Högbom, Đại học Stockholm) RNR đã khiến các nhà khoa học bối rối trong nhiều thập kỷ. Chúng tạo ra các gốc tự do, là một loại phân tử có thể gây tổn hại cho tế bào nhưng cũng rất cần thiết cho một số quá trình sinh hóa. Giải quyết bí ẩn của RNR nằm ở việc tìm hiểu trạng thái gốc hoạt động của chúng, một hiện tượng dường như nghịch lý được phát hiện lần đầu tiên cách đây 50 năm, trong đó protein bản thân là gốc và do đó có số electron lẻ.
Martin Högbom, nhà nghiên cứu tại Đại học Stockholm, người đứng đầu nghiên cứu, cho biết: “Có nền tảng về hóa học, tôi rất ngạc nhiên khi biết rằng enzyme sử dụng các gốc tự do”. “Vào thời điểm đó, ý tưởng xác định xem gốc protein trông như thế nào thậm chí còn xa vời về mặt lý thuyết. Nhưng sự tò mò này đã theo tôi suốt sự nghiệp khoa học của mình.” Trong những năm qua, nhiều hệ thống enzyme đã được công nhận sử dụng hóa học gốc, nhưng cho đến nay người ta vẫn chưa thể quan sát cấu trúc của protein ở trạng thái phản ứng này do tính nhạy cảm vốn có của chúng đối với việc đo lường.
“Chúng tôi sử dụng tia X để đo cấu trúc của protein, nhưng các gốc tự do cực kỳ nhạy cảm với tổn thương bức xạ do các chùm tia X này gây ra”. Nhà khoa học và cộng tác viên SLAC Roberto Alonso-Mori cho biết. “Tia X có thể tạo ra nhiều electron và các gốc khác có thể vô hiệu hóa trạng thái gốc protein mà chúng tôi muốn nghiên cứu.” Sử dụng tia X-quang Linac Coherent Light Source (LCLS) của SLAC, nhóm nghiên cứu đã sử dụng một kỹ thuật tiên tiến gọi là tinh thể học femto giây nối tiếp, cho phép các nhà nghiên cứu quan sát protein và các phân tử khác ở nhiệt độ mà chúng được tìm thấy trong tự nhiên, kết hợp với nhiễu xạ trước khi phá hủy, cho phép các nhà nghiên cứu thu thập thông tin chính xác từ các mẫu tinh tế ngay lập tức trước khi chúng bị tia laser thổi bay. Điều này cho phép họ lần đầu tiên chụp được hình ảnh của protein ở trạng thái gốc hoạt động, cung cấp cái nhìn sâu sắc trực tiếp về cách thức hoạt động của nó khi hoạt động.
Ngoài ý nghĩa nền tảng trong sinh học, phát hiện này còn có tiềm năng điều trị vì RNR rất cần thiết cho quá trình phân chia tế bào.
Cộng tác viên Jan Kern, một nhà khoa học tại Phòng thí nghiệm quốc gia Lawrence Berkeley. cho biết: “Với phương pháp mới này, chúng tôi có thể hiểu được cách kiểm soát và sử dụng tự nhiên các trạng thái phản ứng này, mang lại những tiến bộ tiềm năng trong phương pháp điều trị, đặc biệt là đối với các tình trạng như ung thư”. Để theo dõi, các nhà nghiên cứu hy vọng sẽ mở rộng nghiên cứu của họ sang các dạng khác của enzyme này.
Cộng tác viên Hugo Lebrette, cựu nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm và hiện là trưởng nhóm nghiên cứu tại Đại học CNRS-Toulouse, cho biết: “Chúng tôi mong muốn nghiên cứu các loại ribonucleotide reductase khác, mở rộng hiểu biết của chúng tôi về sự hình thành gốc tự do ở các loại enzyme khác nhau”.
Cộng tác viên Vivek Srinivas, nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm cho biết thêm: “So sánh những điều này có thể cung cấp cái nhìn sâu sắc về việc nhắm mục tiêu các enzyme cụ thể trong các sinh vật có liên quan”. Điều này sẽ mở ra cơ hội quan sát các protein khác nhau ở dạng hoạt động của chúng, với hy vọng rằng điều này có thể định hình lại việc điều trị bệnh. phương pháp.” Mặc dù việc thu thập dữ liệu được thực hiện trong vòng một giờ nhưng nền tảng cho cột mốc quan trọng này đã được đặt trong nhiều thập kỷ, được đánh dấu bằng nền tảng tỉ mỉ, xác định các hệ thống mô hình phù hợp và chuẩn bị mẫu.
Högbom nói: “Niềm đam mê của tôi với các gốc protein đã bắt đầu cách đây gần 30 năm trong quá trình học đại học của tôi. “Khái niệm về enzyme tạo ra và duy trì gốc tự do là một khám phá. Mục tiêu của chúng tôi là hiểu rõ họ protein này và mỗi thí nghiệm, mỗi bài báo sẽ đưa chúng tôi đến gần hơn với mục tiêu đó.
Cấu trúc của gốc protein được xác định bằng cách cho các vi tinh thể của protein gốc tiếp xúc với các xung cực ngắn và cường độ mạnh từ tia laser X. (Ảnh: Martin Högbom, Đại học Stockholm) RNR đã khiến các nhà khoa học bối rối trong nhiều thập kỷ. Chúng tạo ra các gốc tự do, là một loại phân tử có thể gây tổn hại cho tế bào nhưng cũng rất cần thiết cho một số quá trình sinh hóa. Giải quyết bí ẩn của RNR nằm ở việc tìm hiểu trạng thái gốc hoạt động của chúng, một hiện tượng dường như nghịch lý được phát hiện lần đầu tiên cách đây 50 năm, trong đó protein bản thân là gốc và do đó có số electron lẻ.
Martin Högbom, nhà nghiên cứu tại Đại học Stockholm, người đứng đầu nghiên cứu, cho biết: “Có nền tảng về hóa học, tôi rất ngạc nhiên khi biết rằng enzyme sử dụng các gốc tự do”. “Vào thời điểm đó, ý tưởng xác định xem gốc protein trông như thế nào thậm chí còn xa vời về mặt lý thuyết. Nhưng sự tò mò này đã theo tôi suốt sự nghiệp khoa học của mình.” Trong những năm qua, nhiều hệ thống enzyme đã được công nhận sử dụng hóa học gốc, nhưng cho đến nay người ta vẫn chưa thể quan sát cấu trúc của protein ở trạng thái phản ứng này do tính nhạy cảm vốn có của chúng đối với việc đo lường.
“Chúng tôi sử dụng tia X để đo cấu trúc của protein, nhưng các gốc tự do cực kỳ nhạy cảm với tổn thương bức xạ do các chùm tia X này gây ra”. Nhà khoa học và cộng tác viên SLAC Roberto Alonso-Mori cho biết. “Tia X có thể tạo ra nhiều electron và các gốc khác có thể vô hiệu hóa trạng thái gốc protein mà chúng tôi muốn nghiên cứu.” Sử dụng tia X-quang Linac Coherent Light Source (LCLS) của SLAC, nhóm nghiên cứu đã sử dụng một kỹ thuật tiên tiến gọi là tinh thể học femto giây nối tiếp, cho phép các nhà nghiên cứu quan sát protein và các phân tử khác ở nhiệt độ mà chúng được tìm thấy trong tự nhiên, kết hợp với nhiễu xạ trước khi phá hủy, cho phép các nhà nghiên cứu thu thập thông tin chính xác từ các mẫu tinh tế ngay lập tức trước khi chúng bị tia laser thổi bay. Điều này cho phép họ lần đầu tiên chụp được hình ảnh của protein ở trạng thái gốc hoạt động, cung cấp cái nhìn sâu sắc trực tiếp về cách thức hoạt động của nó khi hoạt động.
Ngoài ý nghĩa nền tảng trong sinh học, phát hiện này còn có tiềm năng điều trị vì RNR rất cần thiết cho quá trình phân chia tế bào.
Cộng tác viên Jan Kern, một nhà khoa học tại Phòng thí nghiệm quốc gia Lawrence Berkeley. cho biết: “Với phương pháp mới này, chúng tôi có thể hiểu được cách kiểm soát và sử dụng tự nhiên các trạng thái phản ứng này, mang lại những tiến bộ tiềm năng trong phương pháp điều trị, đặc biệt là đối với các tình trạng như ung thư”. Để theo dõi, các nhà nghiên cứu hy vọng sẽ mở rộng nghiên cứu của họ sang các dạng khác của enzyme này.
Cộng tác viên Hugo Lebrette, cựu nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm và hiện là trưởng nhóm nghiên cứu tại Đại học CNRS-Toulouse, cho biết: “Chúng tôi mong muốn nghiên cứu các loại ribonucleotide reductase khác, mở rộng hiểu biết của chúng tôi về sự hình thành gốc tự do ở các loại enzyme khác nhau”.
Cộng tác viên Vivek Srinivas, nhà nghiên cứu sau tiến sĩ tại Đại học Stockholm cho biết thêm: “So sánh những điều này có thể cung cấp cái nhìn sâu sắc về việc nhắm mục tiêu các enzyme cụ thể trong các sinh vật có liên quan”. Điều này sẽ mở ra cơ hội quan sát các protein khác nhau ở dạng hoạt động của chúng, với hy vọng rằng điều này có thể định hình lại việc điều trị bệnh. phương pháp.” Mặc dù việc thu thập dữ liệu được thực hiện trong vòng một giờ nhưng nền tảng cho cột mốc quan trọng này đã được đặt trong nhiều thập kỷ, được đánh dấu bằng nền tảng tỉ mỉ, xác định các hệ thống mô hình phù hợp và chuẩn bị mẫu.
Högbom nói: “Niềm đam mê của tôi với các gốc protein đã bắt đầu cách đây gần 30 năm trong quá trình học đại học của tôi. “Khái niệm về enzyme tạo ra và duy trì gốc tự do là một khám phá. Mục tiêu của chúng tôi là hiểu rõ họ protein này và mỗi thí nghiệm, mỗi bài báo sẽ đưa chúng tôi đến gần hơn với mục tiêu đó.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://www.nanowerk.com/news2/biotech/newsid=63832.php
- : có
- :là
- :không phải
- $ LÊN
- 10
- 12
- 30
- 50
- 50 năm
- 7
- 8
- 9
- a
- Giới thiệu
- gia tốc
- hoạt động
- thêm
- tiến bộ
- cách đây
- nhằm mục đích
- cho phép
- cho phép
- Ngoài ra
- ngạc nhiên
- an
- và
- ngoài
- các ứng dụng
- LÀ
- các khía cạnh
- At
- lý lịch
- được
- trước
- bắt đầu
- được
- Berkeley
- Ngoài
- sinh học
- Khối
- Xây dựng
- nhưng
- by
- gọi là
- CAN
- Ung thư
- nắm bắt
- Tuyển Dụng
- Nguyên nhân
- pin
- Tế bào
- Trung tâm
- Thế kỷ
- hóa học
- gần gũi hơn
- mạch lạc
- thu thập
- bộ sưu tập
- kết hợp
- khái niệm
- điều kiện
- điều khiển
- có thể
- kết
- nứt
- sự tò mò
- tiên tiến
- hư hại
- dữ liệu
- Ngày
- thập kỷ
- bộ
- Mặc dù
- chi tiết
- xác định
- xác định
- khác nhau
- trực tiếp
- phát hiện
- phát hiện
- Bệnh
- bệnh
- Phòng
- dna
- Cửa
- hai
- suốt trong
- mỗi
- điện tử
- việc làm
- đặc biệt
- thiết yếu
- Ngay cả
- Thực thi
- Mở rộng
- mở rộng
- thử nghiệm
- chuyên môn
- mở rộng
- cực kỳ
- gia đình
- Tên
- lần đầu tiên
- theo
- sau
- Trong
- hình thành
- hình thành
- Cựu
- các hình thức
- Forward
- tìm thấy
- Nền tảng
- Miễn phí
- từ
- chức năng
- cơ bản
- tạo ra
- tạo ra
- mục tiêu
- nền tảng
- Nhóm
- Một nửa
- Có
- cao
- mong
- giờ
- Độ đáng tin của
- HTTPS
- hugo
- i
- ý tưởng
- Xác định
- hình ảnh
- hình ảnh
- in
- bao gồm
- Các bệnh truyền nhiễm
- thông tin
- vốn có
- Đồng tu
- cái nhìn sâu sắc
- những hiểu biết
- ngay lập tức
- tổ chức
- Quốc Tế
- trong
- phức tạp
- điều tra
- IT
- ITS
- chính nó
- Tháng
- jpg
- phòng thí nghiệm
- tia laser
- mới nhất
- lawrence
- lãnh đạo
- học
- Led
- nằm
- ánh sáng
- Lượt thích
- NHÌN
- duy trì
- chính
- nhiều
- đánh dấu
- một giống én
- me
- đo
- đo
- y khoa
- phương pháp
- phương pháp
- tỉ mỉ
- Tên đệm
- sự kiện quan trọng
- kiểu mẫu
- phân tử
- my
- Trinh thám
- quốc dân
- Tự nhiên
- Thiên nhiên
- gần
- Mới
- tại
- con số
- Mục tiêu
- tuân theo
- quan sát
- of
- cung cấp
- Cung cấp
- on
- mở
- Nền tảng khác
- vfoXNUMXfipXNUMXhfpiXNUMXufhpiXNUMXuf
- kết thúc
- Giấy
- mở đường
- hiện tượng
- plato
- Thông tin dữ liệu Plato
- PlatoDữ liệu
- có thể
- tiềm năng
- cần
- chuẩn bị
- quá trình
- Quy trình
- sản xuất
- Sản lượng
- Protein
- Protein
- cho
- cung cấp
- công bố
- r2
- Bức xạ
- triệt để
- công nhận
- có liên quan
- vẫn
- nghiên cứu
- nhóm nghiên cứu
- nhà nghiên cứu
- nhà nghiên cứu
- định hình lại
- kết quả
- Tiết lộ
- sự mặc khải
- roberto
- Vai trò
- s
- Nói
- khoa học
- Nhà khoa học
- các nhà khoa học
- dường như
- có vẻ
- nhạy cảm
- Độ nhạy
- nối tiếp
- định
- một số
- ngắn
- ý nghĩa
- kể từ khi
- Giải quyết
- nguồn
- riêng
- Tiểu bang
- Bang
- Bước
- cấu trúc
- nghiên cứu
- Học tập
- phù hợp
- hệ thống
- nhắm mục tiêu
- nhóm
- kỹ thuật
- việc này
- Sản phẩm
- cung cấp their dịch
- Them
- Trị liệu
- Kia là
- họ
- điều này
- khắp
- Như vậy
- thời gian
- đến
- điều trị
- phương pháp điều trị
- kiểu
- loại
- không rõ
- hiểu
- sự hiểu biết
- độc đáo
- trường đại học
- cho đến khi
- us
- sử dụng
- đã sử dụng
- sử dụng
- Quý báu
- muốn
- là
- Đường..
- we
- Điều gì
- khi nào
- cái nào
- trong khi
- CHÚNG TÔI LÀ
- với
- ở trong
- sẽ
- X-quang
- năm
- zephyrnet
Thêm từ công trình nano
Kỹ thuật in nano cho hình ảnh ba chiều phản ứng với độ ẩm
Nút nguồn: 1786485
Dấu thời gian: Tháng Mười Hai 26, 2022
Kiểm tra cảm biến mới cho các sản phẩm in 3D có thể cải tổ lĩnh vực sản xuất
Nút nguồn: 2554369
Dấu thời gian: Tháng Tư 22, 2024
Thu nhỏ thiết bị lưu trữ bằng nam châm xoắn ốc chirus
Nút nguồn: 2522453
Dấu thời gian: Tháng 22, 2024
Phát hiện xoáy từ trường siêu nhỏ trong vật liệu chứa sắt
Nút nguồn: 2043521
Dấu thời gian: Tháng Tư 2, 2023
3D-BRICKS: sử dụng DNA để tạo ra dòng bóng bán dẫn nano 3 chiều mới
Nút nguồn: 2233493
Dấu thời gian: Tháng Tám 24, 2023
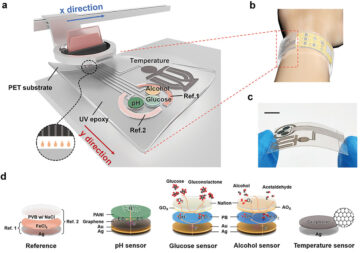
Cảm biến sinh học đeo trên người được in đầy đủ theo dõi lượng glucose, nồng độ cồn, độ pH và nhiệt độ trong mồ hôi
Nút nguồn: 2544132
Dấu thời gian: Tháng Tư 12, 2024
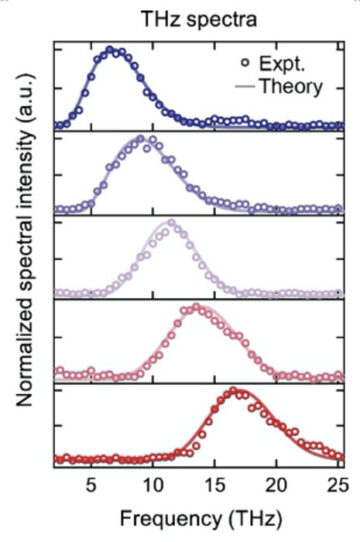
Sơ đồ tạo xung terahertz siêu ngắn mới trong kim cương
Nút nguồn: 1936363
Dấu thời gian: Tháng Hai 3, 2023
Gợi ý nghiên cứu về phương pháp mới để cải thiện điện tử học spin cho công nghệ tương lai
Nút nguồn: 2326495
Dấu thời gian: Tháng Mười 13, 2023
Hợp kim nhôm in 3D có khả năng chống mỏi chưa từng có
Nút nguồn: 2346768
Dấu thời gian: Tháng Mười 24, 2023
Thiết bị cảm biến dựa trên Nanopore khám phá các bệnh thoái hóa thần kinh
Nút nguồn: 1889038
Dấu thời gian: Jan 10, 2023