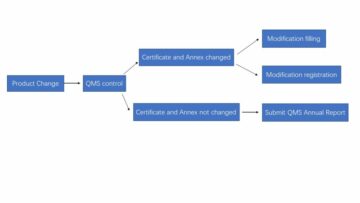
2022年XNUMX月起实施的《医疗器械临床试验质量管理规范》(简称中国GCP)明确规定“临床试验地点必须在国家药品监督管理局备案的医疗器械临床试验机构内”。
自2005年1380月国家药品监督管理局(当时的国家食品药品监督管理总局)公布第一批医疗器械临床研究中心以来,截至2024年XNUMX月,我国共有XNUMX家医院获得开展临床研究资格。
所有1380个中心均拥有在NMPA注册的不同临床专科。我们可以帮助您选择合适的医院并节省市场推广时间。
如需临床试验机构的完整列表,请发送电子邮件至 info@ChinaMedDevice.com.
严格的临床审核
临床审核也在这些地点进行。多年来,临床试验要求不断加强,被发现不合规的知名公司包括西门子和美敦力。
在临床审核中面临更严格审查的 IVD 公司包括德国西门子、英国 RSR 和瑞典 Q-Med。
点击 点击这里 2024年XNUMX月发布的《医疗器械临床试验机构监督检查办法(试行)》
以上厂家临床不达标请点击 点击这里
临床试验审核常见问题请点击 点击这里